文章导读
你是否好奇,肿瘤为何能逃避免疫系统的追杀?西安交通大学一附院任娟教授团队在《自然-通讯》发表重磅成果,首次揭示肿瘤酸性环境如何通过氢离子感受器GPR4“筑起”胶原屏障,阻止免疫细胞 infiltration,导致免疫治疗失效。研究不仅阐明GPR4通过JAK2/STAT3信号双路径调控LOXL2与TGF-β,重塑细胞外基质的全新机制,更提出靶向阻断该通路可逆转免疫排斥,在动物模型中显著提升疗效。这一发现为结肠癌乃至多种实体瘤的免疫治疗提供了全新靶点和联合策略,临床转化前景广阔。
— 内容由好学术AI分析文章内容生成,仅供参考。
肿瘤免疫排斥是导致肿瘤免疫治疗失败的重要原因。细胞外基质形成的物理屏障是介导免疫排斥的关键因素。尽管已知肿瘤缺氧与酸性微环境会加剧肿瘤免疫排斥,但其内在的调控机制尚不明晰。西安交通大学一附院任娟教授团队围绕“酸性环境如何通过氢离子感受器来驱动肿瘤免疫排斥”这一科学问题展开系统研究,通过二次谐波成像、多重免疫荧光等先进技术,实现了对细胞外基质重塑的定量化解析,并从肿瘤微环境力学特性视角出发,阐明了酸性微环境促进免疫排斥的新机制,并明晰了氢离子感受器被肿瘤酸性微环境激活后,如何介导肿瘤免疫排斥的具体机制。

近日,任娟教授在Nature《自然》子刊 Nature Communications《自然-通讯》(一区、影响因子15.7)发表《肿瘤酸性环境经GPR4构筑胶原屏障,促结肠癌免疫排斥》“GPR4 promotes immune exclusion in colon cancer through LOXL2-mediated extracellular matrix remodeling”研究成果,揭示了肿瘤酸性微环境促进肿瘤免疫排斥的关键机制,为开发结肠癌免疫治疗药物提供了新的靶向策略。博士研究生白书衡为唯一第一作者,任娟教授为唯一通讯作者,西交大一附院为唯一论文完成单位。
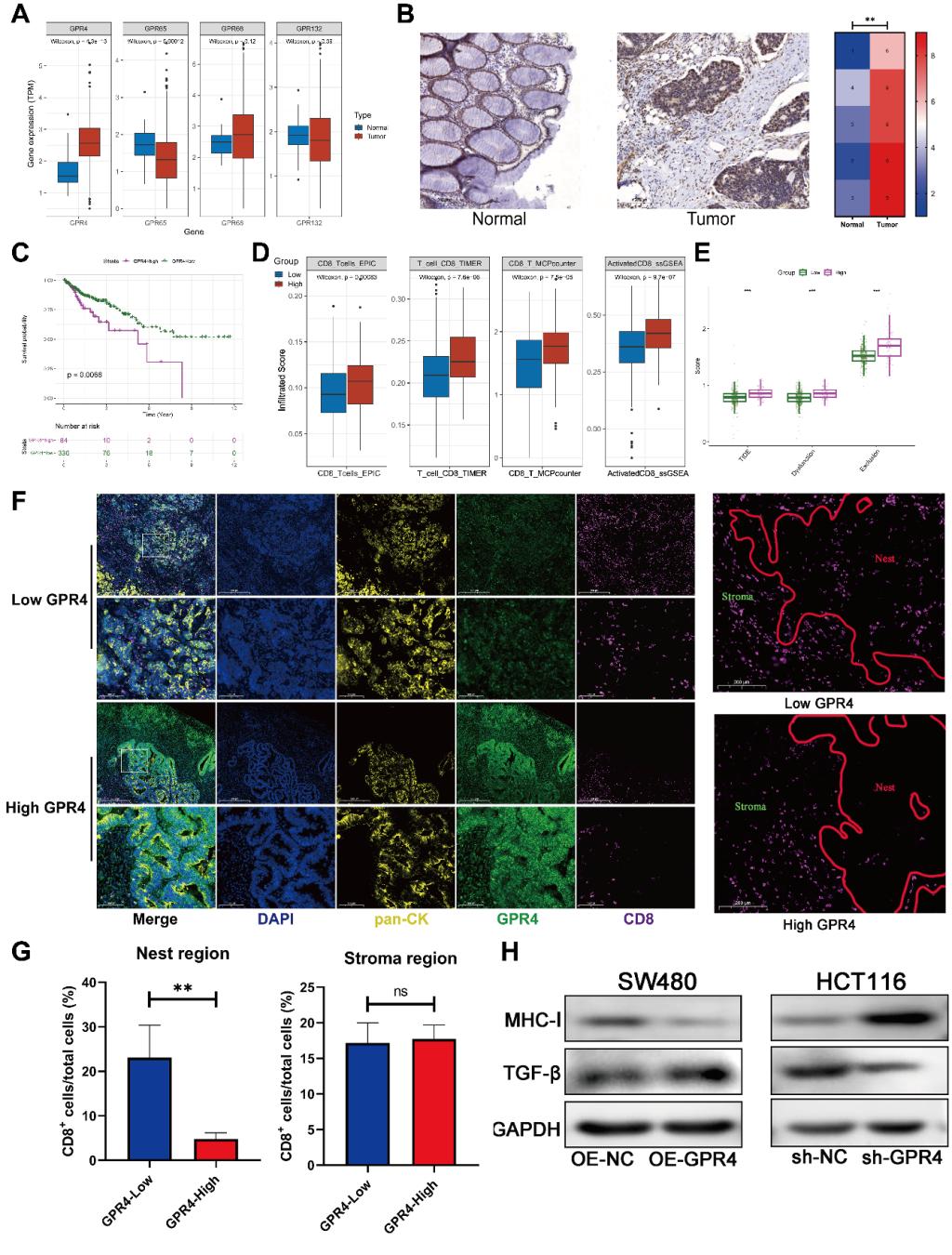
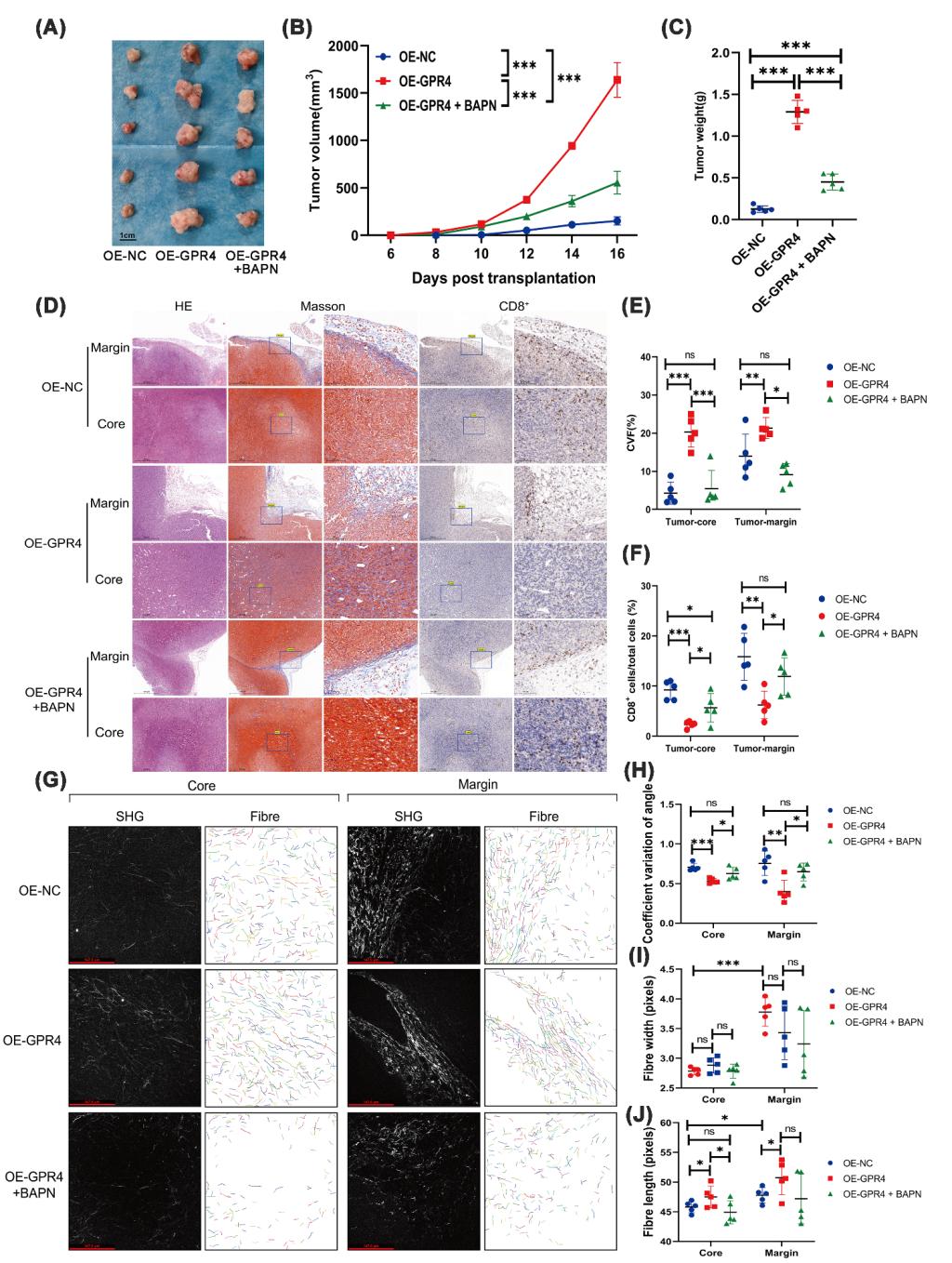
研究发现,作为氢离子感受器的G蛋白偶联受体GPR4在结肠癌中通过JAK2/STAT3信号通路发挥双重作用:一方面调控LOXL2促进胶原纤维排列,另一方面调节TGF-β增强I型胶原表达,从而推动细胞外基质的结构重塑与沉积,最终形成肿瘤免疫排斥性微环境,阻止免疫细胞的浸润。基于上述机制,任娟教授团队设计了通过抑制JAK2/STAT3通路或LOXL2功能来有效逆转肿瘤免疫排斥状态,显著提升了免疫治疗响应,并在动物模型中得到证实。
该研究不仅在理论层面深化了对肿瘤微环境与免疫调节之间复杂关系的认识,更在临床转化方面展现出重要价值:GPR4及其下游信号分子可作为预测免疫治疗效果的生物标志物,并为联合靶向干预提供了新策略,有望改善结肠癌及其他实体瘤的免疫治疗耐受问题。
本研究得到国家自然科学基金面上项目、陕西省重点研发项目及西安交大一附院科研基金的支持,并依托西安交大一附院转化医学中心、生物医学研究中心及生物样本信息资源中心等多个高水平实验平台,体现了临床与基础研究深度融合的创新模式。
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。


















不过单靠GPR4一个靶点,怕是难以根本解决免疫排斥。
那如果同时抑制JAK2和LOXL2,会不会出现副作用?有什么安全性数据吗?
思路挺新颖的。
听说实验室里为了检测LOXL2,还特意弄了个酸性培养箱,真是硬核。
这实验听起来高大上,实际操作估计超费劲。
我前段时间也研究过酸性微环境,确实很难突破免疫屏障。
抑制GPR4的药物目前研发到哪一步了?临床上有没有相关的试验?
其实之前有报道指出GPR4在肺癌也有类似的免疫排斥作用,这次结肠癌的验证更让人信服。
看到GPR4和LOXL2的关联,感觉研究打开了免疫治疗的新方向,期待把这些发现转化到临床,真的很激动,尤其是对结肠癌患者的意义,期待后续更多数据支撑。
这成果真是惊喜!👍