文章导读
你是否想过,无需外部光源也能实现精准高效的光动力抗癌?北京大学第三医院梁晓龙团队最新研发的自发光纳米系统,巧妙利用肿瘤酸性微环境,通过喜树碱与过氧化钙的协同反应,持续释放强光并激活活性氧,突破传统光动力疗法依赖光照和缺氧环境的双重瓶颈。该系统不仅能靶向富集、自供氧、自发光,还可缓释化疗药物,高效诱导肿瘤细胞焦亡,释放免疫“警报”,将“冷肿瘤”变为“热肿瘤”。联合PD-L1抗体后,更显著增强抗肿瘤免疫应答,为中晚期癌症治疗提供全新策略。这项突破性成果已发表于《细胞·生物材料》,或将重塑癌症免疫治疗格局。
— 内容由好学术AI分析文章内容生成,仅供参考。
2025年12月23日,北京大学第三医院超声医学科梁晓龙研究员团队在《细胞·生物材料》(Cell Biomaterials)上发表了题为《喜树碱增强型自发光纳米系统高效激活细胞焦亡以激发抗肿瘤免疫》(“Camptothecin amplified self-luminous nanosystem for highly efficient activation of pyroptosis to stimulate antitumor immunity”)研究成果,研发新型自发光纳米诊疗系统,可实现光动力疗法与化疗的协同增效,高效激活肿瘤细胞焦亡,显著增强抗肿瘤免疫应答。

论文截图
尽管免疫检查点阻断疗法在部分患者中取得了显著效果,但总体响应率仍然有限。寻找能够有效激活全身性抗肿瘤免疫反应的方法,成为当前该领域研究的焦点。细胞焦亡作为一种具有高度免疫原性的细胞死亡方式,能够释放大量炎症因子,激活免疫系统对肿瘤发起攻击。如何高效、精准地诱导肿瘤细胞发生焦亡一直缺乏有效手段。
传统的光动力疗法虽然能够诱导细胞焦亡,但其依赖外部光源照射,而光的组织穿透能力有限,难以到达深部肿瘤。部分化疗药物也可以触发焦亡,但肿瘤细胞往往会对化疗药物产生耐药性,导致治疗效果大打折扣。更为复杂的是,肿瘤微环境通常处于缺氧状态,这进一步限制了传统光动力疗法的效果。
针对上述挑战,梁晓龙团队开发了一种自组装纳米颗粒(CC@PDC)。该系统由两亲性卟啉脂质、喜树碱衍生物和靶向肽组成,同时封装了油酸修饰的过氧化钙和双草酸酯(CPPO)发光底物。在酸性肿瘤微环境中,过氧化钙(CaO₂)可提供氧气(O₂)和过氧化氢(H₂O₂),与CPPO反应后激发喜树碱发出420nm波长的强光,从而高效激活卟啉产生大量活性氧(ROS)。与此同时,喜树碱作为化疗药物缓慢释放,实现了药物增强的自发光光动力-化学联合治疗。这种联合作用能够有效诱导肿瘤细胞发生焦亡,并在与PD-L1抗体联用时,展现出卓越的抗肿瘤免疫效果。
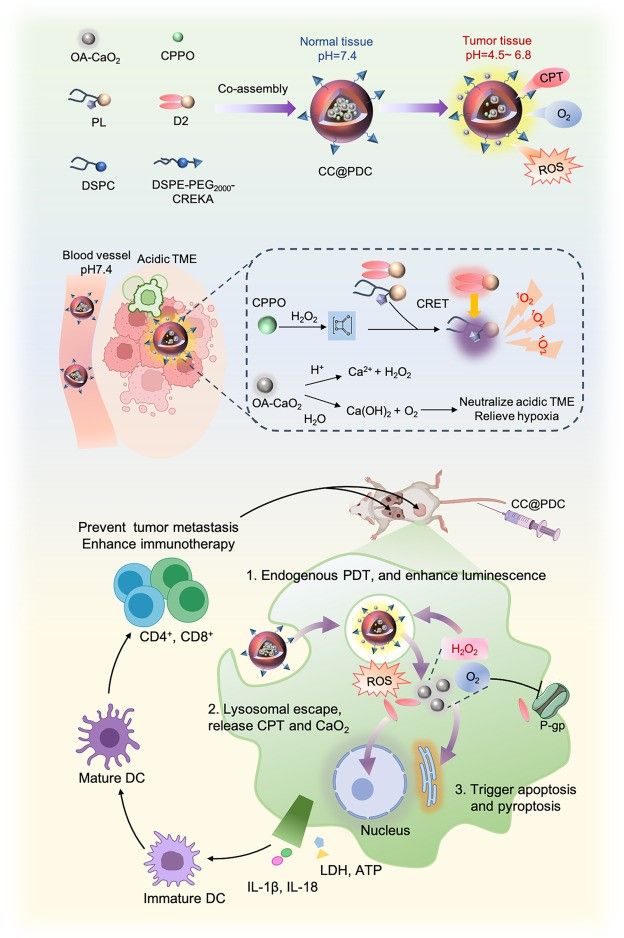
喜树碱增强自发光纳米系统用于光动力-化疗-免疫协同治疗示意图
该研究创新点在于:靶向富集,通过CREKA靶向分子的特异性识别,纳米颗粒可精准聚集于肿瘤组织,减少对正常细胞的损伤。微环境响应供氧,在酸性肿瘤微环境中,CaO₂可持续提供O₂和H₂O₂,既解决了肿瘤缺氧问题,又为自发光反应提供充足底物。自发光驱动光动力,H₂O₂与CPPO发生特异性反应,触发喜树碱衍生物释放并发出强荧光,实现无外部光源依赖的光动力治疗。化疗协同增效,喜树碱衍生物在肿瘤微环境中缓慢释放,发挥化疗作用,与光动力疗法协同诱导肿瘤细胞焦亡,同时避免快速释放导致的毒副作用和耐药性。
研究团队通过相关实验证实,这种纳米系统诱导的细胞焦亡能够释放大量损伤相关分子模式,促进树突状细胞成熟和抗原呈递,进而激活细胞毒性T淋巴细胞。当与PD-L1抗体联合使用时,该系统展现出显著的协同抗肿瘤效果,重塑了肿瘤免疫微环境,使“冷肿瘤”转变为“热肿瘤”,提高了肿瘤对免疫检查点阻断疗法的敏感性,有望为中晚期肿瘤患者提供更具针对性的治疗策略。
北京大学第三医院超声医学科吴睿麒博士为本文第一作者,梁晓龙为论文通讯作者。该研究得到国家自然科学基金资助。
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。




















靶向富集减少损伤正常细胞,这点对提高患者生活质量很重要。
之前家人用过免疫疗法,效果有限,希望这种新方法能带来转机。
这种联合疗法听起来很全面,但成本会不会很高?普通患者用得起吗?
作为医学生,想问下这个纳米系统的生物相容性怎么样?会不会有长期毒性?
化疗药物缓慢释放的设计可以降低耐药性,这点比较实用。
自供氧系统解决了缺氧问题,那对深部肿瘤效果如何?有没有具体数据?
有点专业看不太懂,但感觉是重大突破,希望早日应用!
肿瘤微环境响应这点挺巧妙的,希望能早点看到动物实验数据。
之前看过类似的光动力研究,但自发光设计确实新颖,不知道临床转化周期要多久?
这个研究方向很有前景啊,感觉能解决传统疗法的穿透性问题。