研究揭示光合蓝细菌超分子复合体组装与能量传递的结构基础
文章导读
你是否好奇,微小的蓝细菌如何在极端环境下高效捕获光能?最新研究揭开了一项惊人发现:在缺铁条件下,蓝细菌会构建出精密的“光能收集机器”——IsiA蛋白围绕光系统I形成多层超复合体,但其结构与工作机制一直成谜。中国科学院生物物理研究所团队利用冷冻电镜,首次解析了两种超分子复合体(PSI3-IsiA43和PSI1-IsiA13)的原子分辨率结构,揭示了上千个色素的排布规律及能量逐层传递的路径。这项突破不仅阐明了光捕获与能量传输协同运作的分子基础,更为理解光合生物适应环境胁迫提供了全新视角。
— 内容由好学术AI分析文章内容生成,仅供参考。
光合作用的核心在于光能捕获与电子能量转移高效协同。在蓝细菌中,缺铁条件下表达的铁应激诱导蛋白A(IsiA)会围绕光系统I(PSI)形成多种不同类型的超复合体,以增强光能捕获和光调控能力。其中,多层IsiA-PSI复合体在蓝细菌适应环境胁迫中发挥重要作用,但学界对其精细的三维结构、组装机制及能量传递途径尚不明晰。
2025年12月20日,中国科学院生物物理研究所等研究团队利用单颗粒冷冻电镜手段,解析了来自嗜热蓝细菌(Thermosynechococcus elongatus BP-1)在缺铁条件下分离出的两种不同类型PSI-IsiA超复合物(PSI3-IsiA43和PSI1-IsiA13)的三维结构。研究揭示了双层IsiA围绕三聚体或单体PSI核心形成的精细空间架构及其一千余个色素的组织分布,并结合原子力显微镜原位成像,观察到这些超复合体在膜内的天然分布特征。
团队通过深入分析PSI-IsiA超复合体结构,阐明了双层IsiA蛋白与PSI结合形成稳定超分子复合体的机制,并结合荧光共振能量转移计算,揭示了能量从外层IsiA、内层IsiA到PSI核心的传递路径。团队进一步从三维结构层面,揭示了光捕获和能量传输的协同机制。
该研究为学界探讨光合细菌在铁匮乏等生存环境胁迫下优化能量利用和保护光系统提供了分子基础。
相关研究成果发表在《自然-通讯》(Nature Communications)上。研究工作得到国家自然科学基金委员会等的支持。
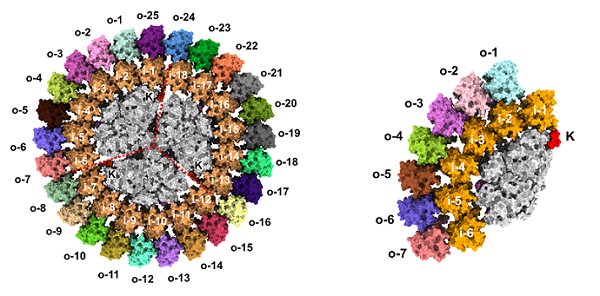
蓝细菌光合复合物PSI3-IsiA43(左)和PSI1-IsiA13(右)的冷冻电镜结构
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。

















蹲一个后续研究,想知道其他环境胁迫下会不会形成不同结构
之前做光合蛋白总测不准能量转移路径,原来缺铁环境会形成这种超复合体
双层色素排列看着像蜂窝结构,不知道能量传递效率能提高多少
这个结构解析太清晰了,终于搞懂IsiA怎么组装的了