文章导读
想象一下,一种能够主动“牵引”神经细胞的神奇水凝胶——这不再是科幻,而是清华团队的最新突破!传统神经修复材料难以模拟人体细胞外基质的动态力学环境,导致细胞难以深层浸润。耿洪亚团队创新性地开发出具有“负应力效应”的胶原蛋白水凝胶,在外力作用下竟能主动产生牵引力而非阻力,完美复刻天然组织的力学信号。实验证明,该材料使神经细胞浸润深度提升21.6倍,增殖密度激增76.7倍!这项登顶《先进功能材料》的研究,不仅揭示了水合介导的负应力新机制,更为三维细胞培养与神经再生开辟了新路径,千万神经损伤患者的康复曙光或许就在其中。
— 内容由好学术AI分析文章内容生成,仅供参考。
细胞的生理活动十分依赖于与细胞外基质(ECM)之间的力学相互作用。在神经修复领域,ECM的牵引行为可以显著促进神经细胞的可塑性,包括轴突延伸、定向排列、神经营养因子表达及再髓鞘化等,从而帮助受损神经恢复功能连接。然而目前人工合成的水凝胶基质大多为静态的刚度或黏弹性力学调控,难以再现ECM中普遍存在的动态牵引行为,限制了细胞的三维深层浸润与神经功能重建。
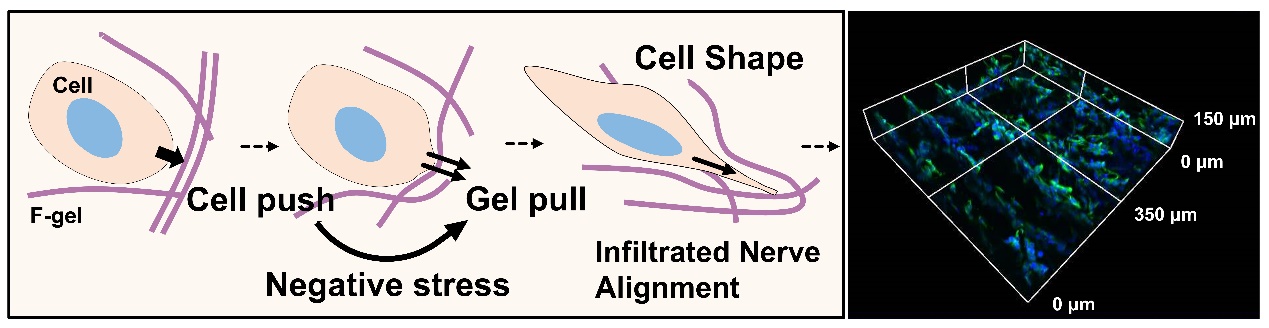
图1.负应力模拟天然ECM的牵引行为以重塑细胞
针对这一难题,清华大学深圳国际研究生院耿洪亚助理教授团队基于在低温生物工程和控冰技术方面的积累,开发了一种具有仿生天然细胞外基质的“负应力”效应的胶原蛋白水凝胶(F-gel),该材料能在外力压缩时,沿加载方向产生主动的牵引力(负应力),而非传统材料被动的抗压阻力(正应力),从而成功模拟天然ECM的牵引力信号,显著促进了神经细胞定向排列与深度浸润(图1)。
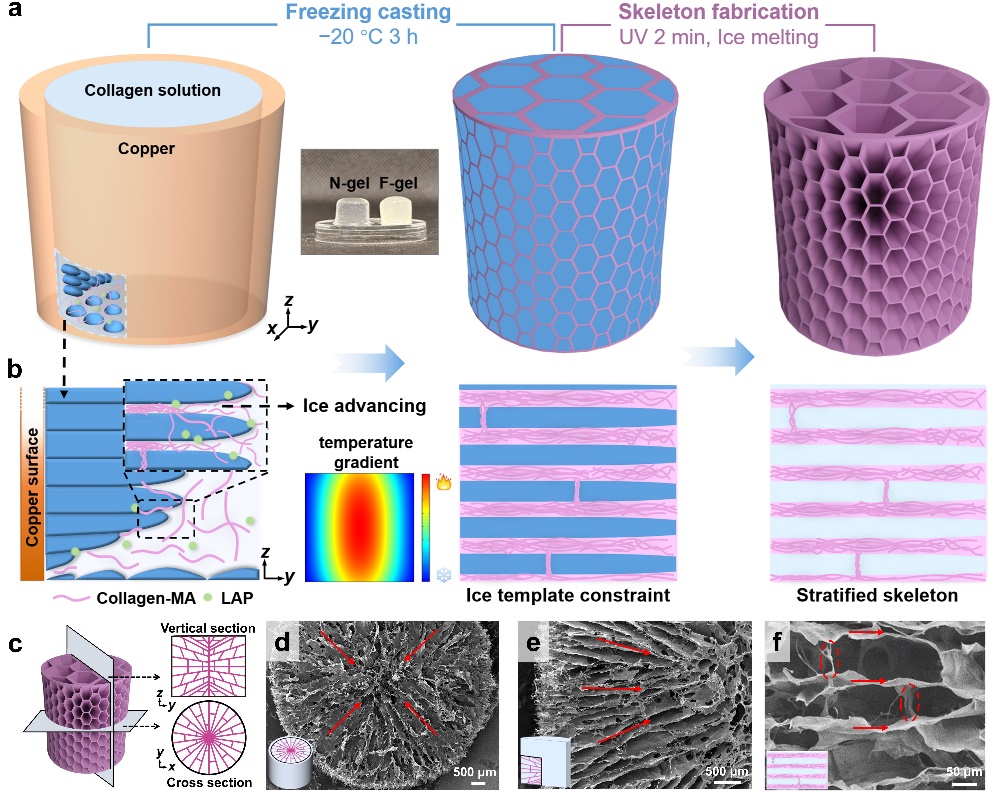
图2.使用正交冰模板法构建负应力水凝胶
研究团队采用正交温度梯度下的定向冷冻策略,使胶原蛋白在冰晶生长过程中发生富集与重排,形成由层状通道和层间桥接构成的各向异性骨架(图2)。与常规均质水凝胶不同,F-gel在受压时并非产生力学抵抗,而是表现出沿加载方向的反常收缩行为,即负应力响应。实验结果表明,低固含量的F-gel负应力最大值可达−27.77kPa,随着固含量升高,可以转变为常规正应力。这种力学行为的“开关”转换,源于材料内部独特的层间桥结构以及水合状态的动态变化,从而实现对力学信号方向与幅值的可编程调节(图3)。
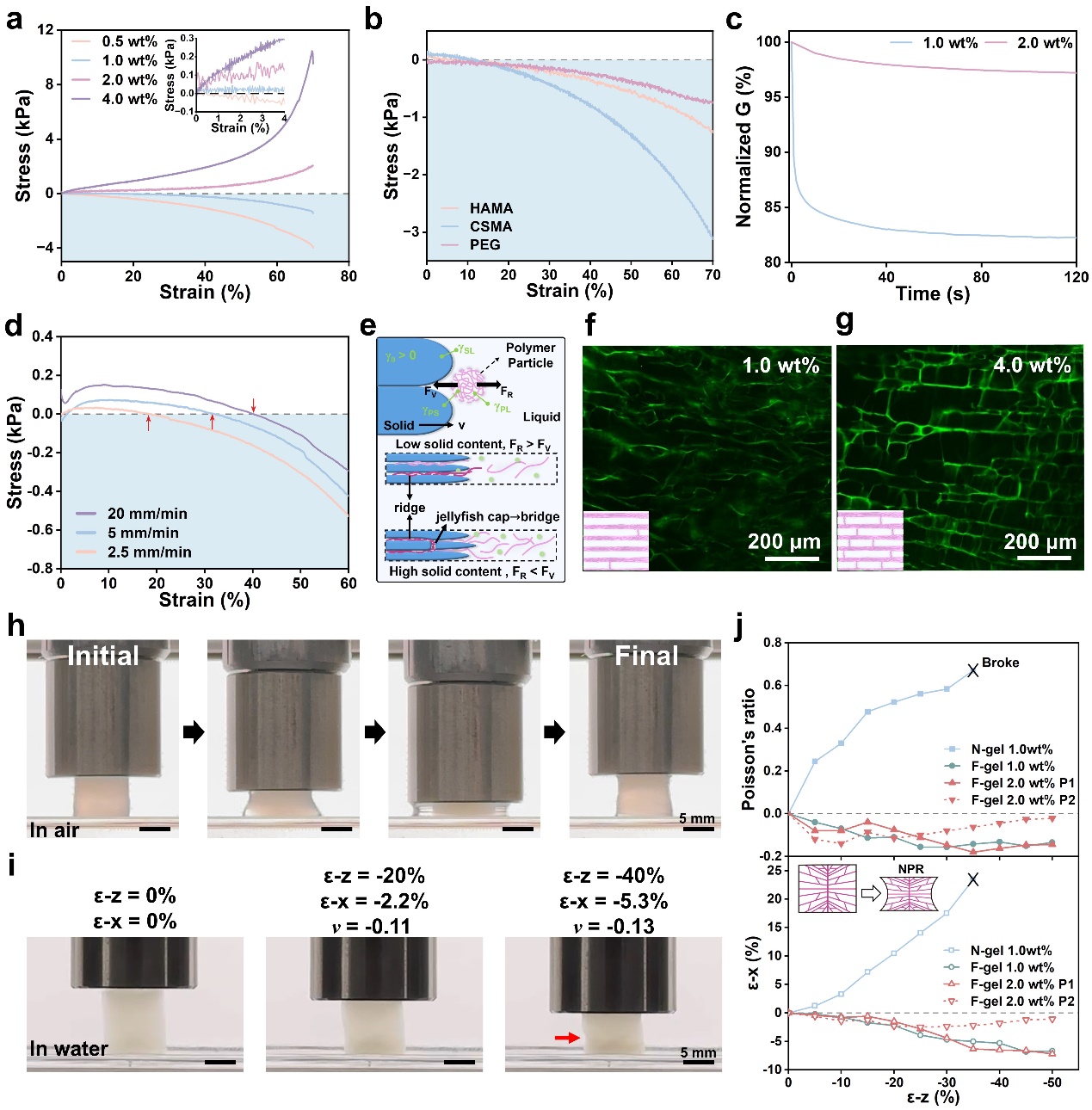
图3.负应力水凝胶结构与力学的可编程调节
研究团队进一步揭示了负应力的分子机制:在分层网络中,水分子通过水合氢键在胶原链之间形成可调控的“水桥”交联。在外力加载下,低固含量的F-gel缺少层间桥接的限制,自由水被快速排出,链段靠近诱发水桥与分子间氢键协同重组,导致网络发生体积塌缩并释放出宏观牵引力,该机制通过一系列氢键调节实验和多尺度结构表征得到验证(图4)。研究还发现,该冷冻铸造策略可扩展至天然蛋白、天然多糖以及人工合成高分子等多种水凝胶体系,展现出良好的普适性。
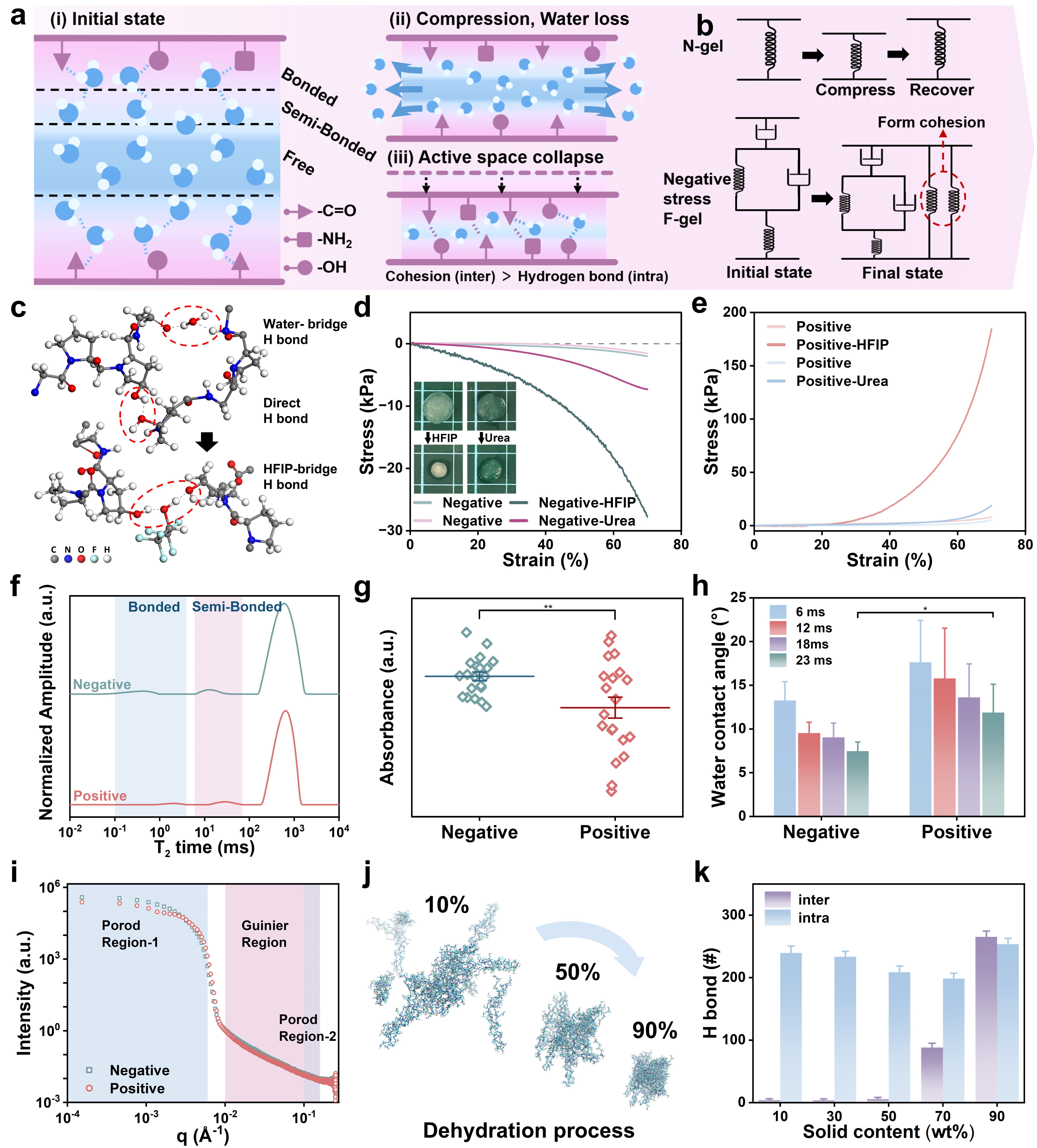
图4.水合介导的分子层坍缩负应力机制
研究团队以人神经母细胞瘤细胞(SH-SY5Y)为模型进行了概念验证。实验证明,负应力能有效引导细胞定向排列,并促进其向材料内部深层浸润。F-gel中细胞的平均浸润深度达到336.30微米,是传统均质水凝胶的21.6倍,细胞增殖密度提升了76.7倍。机制研究表明,负应力效应依赖整合素介导的黏附与ROCK信号通路,并伴随YAP/TAZ的核转位,提示负应力可有效激活细胞机械转导过程。
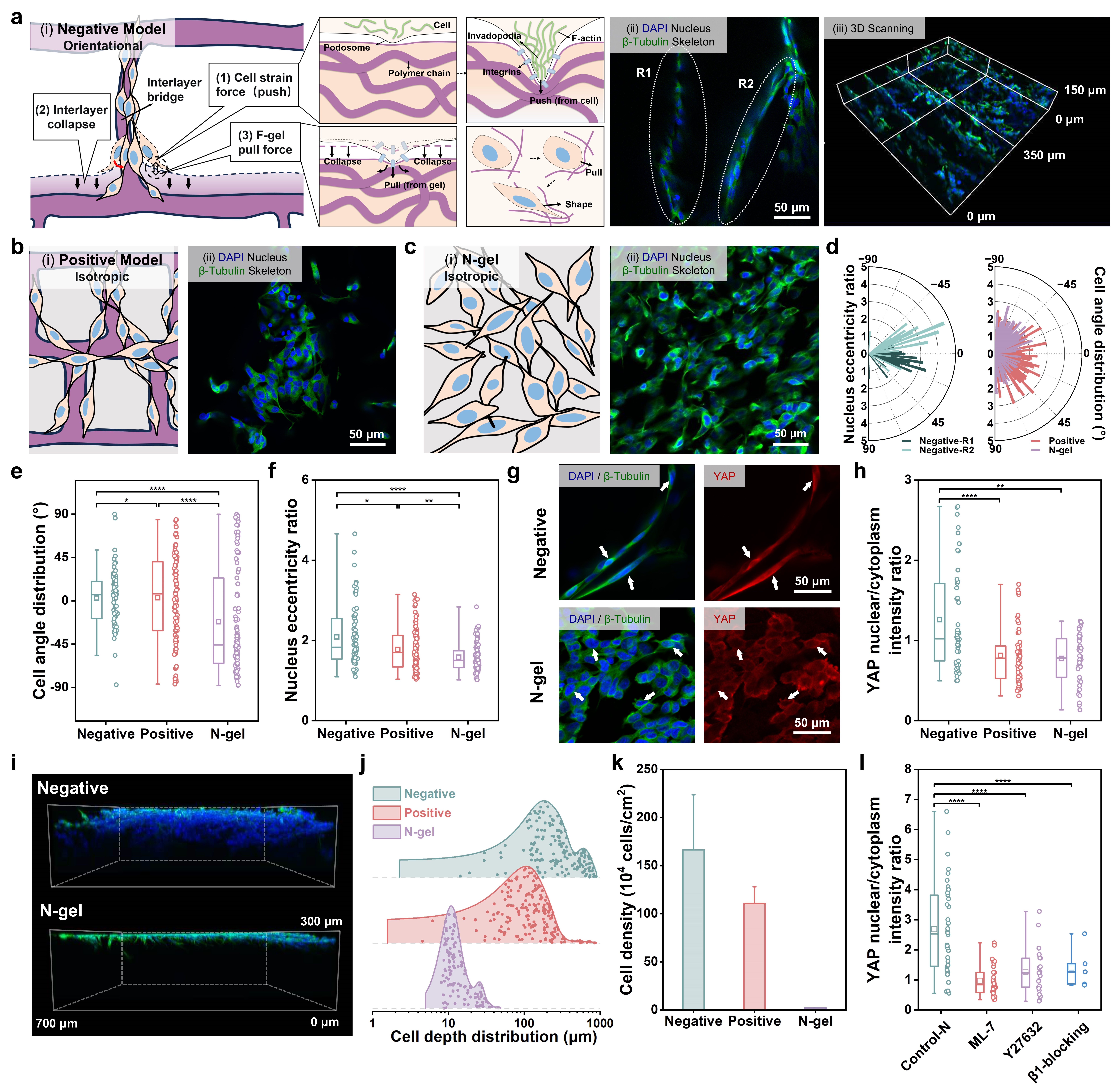
图5.负应力诱导神经细胞定向排列与深层浸润
研究提出了一种通过调控材料水合状态与微结构来编程负应力行为的新范式,有助于加深对细胞—ECM力学相互作用机制的理解,并为三维细胞培养、神经再生及组织工程支架的设计提供了新的技术基础。
研究成果以“水合介导的负应力水凝胶用于三维细胞深层浸润”(Hydration-Mediated Negative Stress Hydrogel for 3D Cell Infiltration)为题,于12月16日发表于《先进功能材料》(Advanced Functional Materials)。
清华大学深圳国际研究生院助理教授耿洪亚为论文通讯作者、深圳国际研究生院2023级博士生侯涵译为论文第一作者。研究得到国家自然科学基金、北京市自然科学基金、广东省科技厅及深圳市财政局等的支持。
论文链接:
https://advanced.onlinelibrary.wiley.com/doi/10.1002/adfm.202524867
供稿:深圳国际研究生院
编辑:李华山
审核:郭玲
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。


















从分子机制到细胞验证都很完整,基础研究做得很扎实
恭喜团队!期待在Advanced Materials上看到更多成果
这种可编程力学特性在再生医学领域潜力巨大
材料设计很巧妙,用冰模板法控制结构
看到细胞能深入300多微米,这技术对组织工程帮助很大
所以这个水凝胶能模拟人体自身ECM的牵引力?🤔
耿老师团队又发顶刊了,清华深研院真强
不太懂负应力原理,但细胞浸润提升21倍这个数据很惊人
希望早日投入临床应用,造福更多患者
这个研究太厉害了!神经修复终于有新突破了👍