研究开发出一种糖环双位点选择性C-烷芳基化反应
文章导读
药物研发中,糖分子修饰为何总陷入“立体混乱”的困境?中科院团队突破性开发的光氧化还原催化技术,让糖环双位点精准修饰成为可能。通过自由基Smiles重排与空间导向双重控制,成功实现1,2-顺式构型产物的高效合成,产率高达84%且完全规避副产物。这项技术不仅能兼容单糖、二糖及多种活性官能团,更在抗肿瘤活性测试中展现出巨大潜力,为糖基药物研发开辟了模块化改造新路径。
— 内容由好学术AI分析文章内容生成,仅供参考。
众多临床药物和活性分子均以糖结构为核心骨架,药物研发往往需要对糖环多个位点进行差异化修饰,构建具有三维结构多样性的分子库,从而筛选出更高活性的候选药物。现有糖烯双碳官能化技术既难以实现差异化碳基官能团的同步引入,也无法对最终产物的立体构型进行精准构筑。
针对这一难题,中国科学院成都生物研究所提出了双重立体控制反应机制的解决方案:通过糖烯C3位取代基的“空间导向”作用,以及自由基Smiles重排过程中的顺式稠合双环过渡态,使反应高效生成1,2-顺式、2,3-反式构型的产物。以葡萄糖烯为模型底物时,目标产物2-C-支链芳苷的产率达84%,且仅生成α-构型,解决了传统反应“立体混乱”的难题。
通过该策略,研究团队实现了对不同保护基烯糖的精准C-烷芳基化,制备了一系列结构多样性的2-C-支链芳苷。从葡萄糖、半乳糖等单糖到纤维二糖、乳糖等二糖衍生的糖烯,均能高效参与反应,甚至含游离羟基的糖烯也能转化为目标产物,省去了繁琐的保护基操作。此外,反应还兼容卤素、酮基、酰胺基、膦酸酯基等多种官能团,可轻松引入糖、氨基酸、肽等复杂结构片段,芳基范围也涵盖苯环、吡啶、嘧啶、噻吩等,为构建多样化糖衍生物库提供了充足原料。
为验证该方法的实用价值,研究团队开展了系统的下游衍生化与生物活性评估。初步生物活性测试显示,合成的2-C-烷基膦酸酯芳苷表现出优异的抗肿瘤潜力。
研究团队创新性地将光氧化还原催化与自由基Smiles重排相结合,开发出一种糖烯区域和立体选择性1,2-烷芳基化反应,实现了糖环双位点的精准同步碳官能团化修饰,为构建结构多样的复杂糖衍生物提供了模块化解决方案,有望加速糖基抗肿瘤药物、降糖药物等的研发进程。
相关研究成果以Streamlined Sugar Diversification via Photoredox-Catalyzed Regio- and Stereoselective 1,2-Alkylarylation of Glycals为题,发表在《德国应用化学》上。
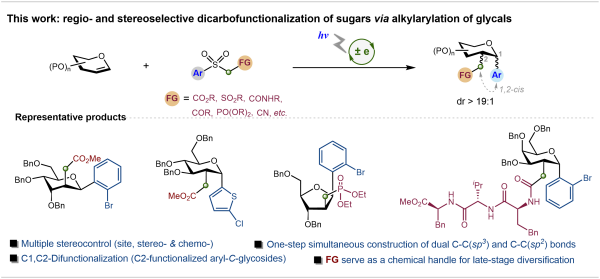
糖环双位点高区域与立体选择性C-烷芳基化
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。




















作者能讲讲这个反应在降糖药物研发中的具体应用吗?
不太懂化学原理,但看到抗肿瘤潜力就很期待😊
双重立体控制机制真的很巧妙,解决了传统方法的立体混乱问题
这个研究对药物开发太重要了,希望能尽快看到临床应用!