文章导读
当癌细胞疯狂增殖时,它们究竟在细胞核内上演着怎样不为人知的戏码?北京大学生命科学学院最新研究首次揭开了代谢酶ALDOA的双面人生:这个长期被认为只在细胞质工作的"能量工程师",竟能在特定泛素化修饰的指引下潜入细胞核,与关键转录因子p65联手激活致癌信号通路。更惊人的是,研究团队发现了阻断这一过程的新靶点——通过干扰ALDOA的泛素化而非其传统酶活性,能有效增强化疗敏感性,为攻克"癌王"胰腺癌的耐药难题提供了全新治疗策略。
— 内容由好学术AI分析文章内容生成,仅供参考。
2025年10月4日,北京大学生命科学学院郑晓峰教授团队在Cell Death & Differentiation期刊发表了题为“K11- and K29-ubiquitination-mediated nuclear translocation of glycolytic enzyme aldolase A promotes pancreatic cancer progression by NF-κB activation”的研究成果。该研究揭示了醛缩酶A(ALDOA)在细胞核内不依赖于其醛缩酶活性的非经典功能,即其在K11和K29类型特异性泛素化修饰的精细调控下发生核转位,通过激活NF-κB信号通路促进胰腺癌的发生发展。该研究揭示ALDOA在癌症信号转导通路中发挥重要调控作用。

论文截图
胰腺导管腺癌(PDAC)预后极差,深刻理解其分子发病机制有助于开发新型疗法。肿瘤代谢重编程,特别是糖酵解通路的异常活化,是驱动肿瘤恶性进展的关键因素。ALDOA作为该通路的关键酶,通常被认为在细胞质中行使经典的代谢调控功能,ALDOA是否能够发生细胞核转位并发挥非经典功能有待于阐明。
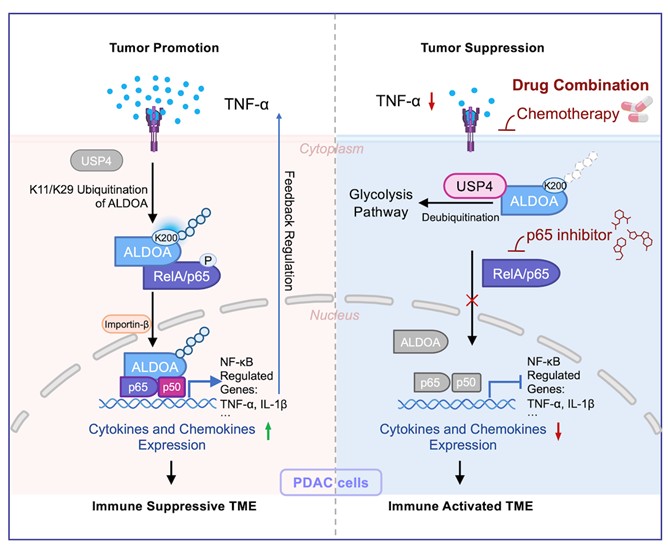
本研究揭示了胰腺导管腺癌(PDAC)中ALDOA在炎症微环境调控下发挥非经典功能的全新机制。我们的研究发现,在肿瘤坏死因子(TNF-α)刺激下,ALDOA第200位赖氨酸(K200)发生K11/K29类型的特异性泛素化修饰,进而由细胞质转位至细胞核。在核内,ALDOA与转录因子p65结合形成复合物,共同结合于包括TNF-α在内的多个促癌基因启动子区域,增强其转录活性,进而放大NF-κB信号通路,促进胰腺癌的进展。
该调控过程形成一个正反馈环路:肿瘤微环境中的TNF-α诱导ALDOA泛素化与核转位,核内ALDOA-p65复合物进一步促进TNF-α表达,持续激活致癌信号。进一步利用小鼠进行功能实验,证实破坏该环路可显著抑制肿瘤生长。在此基础上,我们发现靶向ALDOA泛素化(而非其酶活性)可有效阻断该通路,增强化疗敏感性,这种靶向策略能够有效提高p65抑制剂与化疗药物联用的协同抗肿瘤效果,为克服胰腺癌化疗耐药提供了新思路。
示意图
郑晓峰为该论文的通讯作者,北京大学生命科学学院2021级博士研究生周思汝为该论文的第一作者,2021级博士研究生李钰琳、2020级博士研究生王超与2022级博士研究生赵瑜涵在该研究中提供了帮助。该研究得到北京大学生命科学学院、基因操控与功能研究国家重点实验室、国家自然科学基金委、科技部重点研发项目的大力支持。
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...