研究发现癌细胞与肿瘤相关巨噬细胞代谢互作促进肝癌转移新机制
文章导读
癌细胞如何策反免疫细胞成为自己的"帮凶"?中科院最新研究揭开肝癌转移的隐秘通道。科学家发现肿瘤相关巨噬细胞竟会通过"乳酸-脂质过氧化-乙酸"代谢通路,为癌细胞提供能量补给。当癌细胞释放乳酸,巨噬细胞就会启动脂质过氧化反应产生乙酸,这些乙酸又反过来促进癌细胞合成乙酰辅酶A,增强其转移能力。这一恶性循环的发现不仅揭示了肝癌转移的新机制,更为阻断癌症扩散提供了全新靶点——通过干预巨噬细胞的ALDH2通路,有望切断这条致命的"补给线"。
— 内容由好学术AI分析文章内容生成,仅供参考。
10月20日,中国科学院上海营养与健康研究所鲁明研究组等,报道了肿瘤相关巨噬细胞(TAMs)与肝癌细胞之间“乳酸-脂质过氧化-乙酸”的全新代谢互作模式,揭示了TAMs作为微环境乙酸供应源,通过增加肝癌细胞乙酰辅酶A合成,促进肝癌转移的作用机制,为肝癌转移提供了潜在的微环境干预靶点。
乙酰辅酶A是细胞内关键的代谢中间物,是糖、脂质和氨基酸的分解代谢产物,也是脂质合成和三羧酸循环的起始代谢物,可作为蛋白质乙酰化修饰的底物影响基因表达的表观调控。
为寻找肝癌微环境中乙酸的来源,研究人员对肝癌微环境中不同的原代免疫细胞和基质细胞进行筛选,并利用体内清除实验和体外诱导的TAMs进行分析验证,鉴定出TAMs可特异性促进肝癌细胞乙酸水平提升,并证实TAMs是通过分泌游离形式的乙酸到微环境中来实现这种特异性效应。机制研究发现,TAMs中脂质过氧化-乙醛脱氢酶2途径是调控其乙酸生成和分泌的关键代谢途径。
研究发现,抑制TAMs中ALDH2或脂质过氧化途径,均可减弱TAMs促肝癌细胞体外迁移的能力。这种效应是通过抑制肝癌细胞乙酰辅酶A合成和组蛋白乙酰化实现。研究进一步利用髓系特异性敲除Aldh2小鼠,构建肝癌原位移植瘤模型发现,敲除TAMs的Aldh2可减少原发瘤中肝癌细胞的乙酸水平,并抑制肝癌的肺转移。以上体内外研究获得的机制研究结果,在人肝癌样本中也得到验证,即人肝癌组织中ALDH2+ TAMs浸润程度与临近肝癌细胞组蛋白乙酰化水平呈正相关。研究通过一系列筛选和验证,鉴定出癌细胞来源的乳酸是TAMs脂质过氧化-ALDH2途径激活的诱导因子。乳酸可通过提高活性氧水平和上调Nrf2的表达激活TAMs的脂质过氧化-ALDH2途径,从而形成肝癌细胞和TAMs之间“乳酸-脂质过氧化-乙酸”的互作环路。
上述研究揭示了肝癌细胞与TAMs之间新的代谢互作模式,为解析局部代谢微环境调控癌细胞表型转化的机理提供了新思路。同时,研究发现脂质过氧化途径可作为TAMs乙酸的主要来源,为靶向TAMs的脂质过氧化-ALDH2通路干预肝癌转移提供了理论依据。
相关研究成果在线发表在《自然-代谢》(Nature Metabolism)上。研究工作得到国家重点研发计划和国家自然科学基金等的支持。
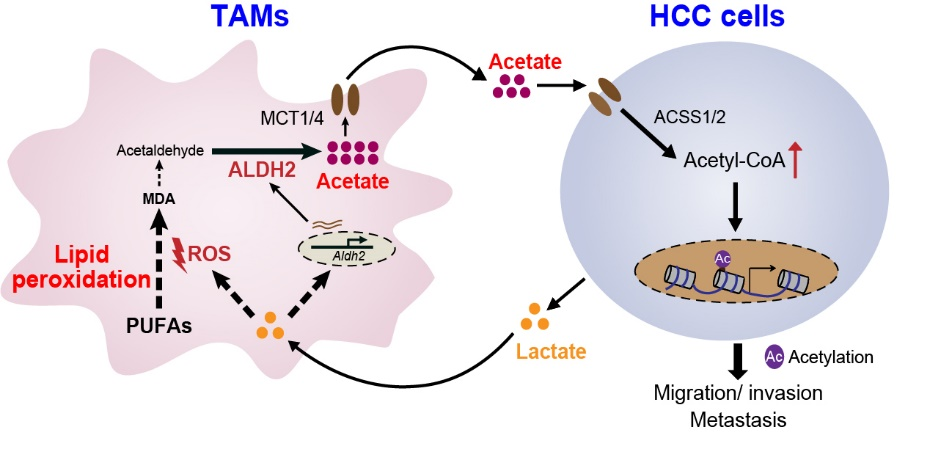
TAMs与肝癌细胞间的“乳酸-脂质过氧化-乙酸”代谢互作模式
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...