研究揭示人逆转座子LINE-1靶向整合基因组重要机制
文章导读
基因组中的“隐形杀手”LINE-1如何精准靶向DNA而不引发混乱?最新《科学》研究首次揭秘:中科院团队通过冷冻电镜捕捉到LINE-1逆转座酶ORF2p的活性瞬间,发现它竟“认准”DNA复制时的特殊结构(如滞链flap),实现分步切割与cDNA合成。这一机制不仅解释了癌症、衰老中基因组紊乱的根源,更颠覆了学界认知——原来LINE-1的跳跃与细胞周期紧密联动!研究为靶向调控药物研发打开新窗口,立即掌握基因组稳定的底层逻辑。
— 内容由好学术AI分析文章内容生成,仅供参考。
人类基因组中存在大量具有“跳跃”能力的逆转座子序列。在胚胎发育早期、免疫及神经系统等特定阶段和环境下,它们会被激活并发挥重要生理功能。在病毒感染、肿瘤发生及机体衰老等状态下,它们通常会持续异常活化,使基因调控紊乱和基因组不稳定。
人体唯一具有自主转座活性的逆转座子——长散在元件1(LINE-1),是大多数逆转座子的迁移载体。其异常逆转座活性,被认为与病毒基因整合、癌细胞及衰老细胞中的基因组紊乱等相关。LINE-1逆转座过程,由其编码的逆转录酶ORF2p,通过靶向启动逆转录(TPRT)机制完成。目前,学界关于其靶向整合的分子机制尚不明晰。
10月9日,中国科学院生物物理研究所研究团队,系统解析了LINE-1逆转座过程中RNA识别、DNA靶向切割及核酸内切酶活性调控等问题,阐明了复制偶联的逆转座机制。在该研究中,科研人员纯化了处于活跃转座状态的ORF2p-内源核酸复合物,并通过单颗粒冷冻电镜解析了高分辨率三维结构,揭示了ORF2p通过表面强电荷与基因组DNA相结合,在RT逆转录活性中心通过多个氨基酸变构调节,进行cDNA合成的分子模型。
同时,研究团队建立了高效的ORF2p体外DNA切割体系,发现了ORF2p对特定分叉结构的DNA底物,尤其是DNA复制后滞链特有的flap结构,表现出较高的活性。进一步,核酸内切酶结构域的构象变化,使ORF2p实现DNA双链的分步切割。
这一研究首次证明了ORF2p是依赖于DNA底物结构的核酸内切酶,揭示了LINE-1整合与细胞复制周期相关的分子基础。同时,该研究从结构和生化角度,阐明了LINE-1逆转座过程中,核酸底物结合模式和DNA结构介导的靶向切割机制,揭示了逆转座酶在进化过程中的保守和变异特征,即逆转录活性高度保守,且DNA识别与切割方式存在显著差异,刷新了学界对LINE-1逆转座机制的认知,为基于逆转座调控的药物研发提供了新的理论依据。
相关研究成果以Mechanism of DNA targeting by human LINE-1为题,发表在《科学》(Science)上。研究工作得到国家自然科学基金委员会、科学技术部、中国科学院的支持。
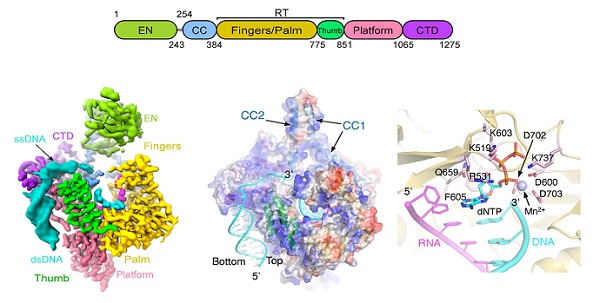
LINE-1 ORF2p功能逆转座复合物的结构
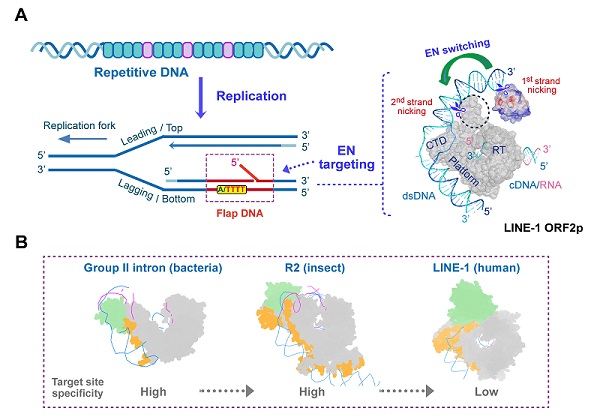
LINE-1逆转座酶靶向切割DNA的分子机制
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...