研究人员开发出靶向清除Tau蛋白的新型细胞疗法
文章导读
阿尔茨海默病的“罪魁祸首”Tau蛋白,终于有了精准“清道夫”?中国科学院院士谭蔚泓与研究员邱丽萍团队突破性开发出一种基于核酸适体的单核细胞疗法,无需基因编辑,即可让免疫细胞主动深入大脑,靶向识别并吞噬致病Tau蛋白。该疗法不仅显著减轻神经炎症、保护神经元,更在小鼠模型中持续改善记忆与认知能力,且无明显副作用。这项发表于《自然-生物医学工程》的研究,或将重塑阿尔茨海默病治疗格局,为神经退行性疾病带来全新希望。
— 内容由好学术AI分析文章内容生成,仅供参考。
目前尚无能够有效预防或缓解阿尔茨海默病病程的疗法。有研究表明,细胞外的Tau蛋白以类似朊病毒的方式在神经网络中扩散,引发连锁性的神经元损伤,这可能是推动阿尔茨海默病病情恶化的关键因素。尽管靶向胞外Tau蛋白的疗法颇具潜力,但其发展面临挑战。因此,亟待开发能够有效干预Tau蛋白相关病理过程的新疗法。
近日,中国科学院院士、杭州医学研究所研究员谭蔚泓与研究员邱丽萍团队,开发出基于核酸适体的单核细胞疗法。该疗法能够高效清除阿尔茨海默病脑内的致病性蛋白Tau,为神经退行性疾病提供了新的治疗策略。
研究团队通过非基因编辑手段,将一种对Tau蛋白具有高亲和力的核酸适体“安装”在单核细胞表面,构建出一套清除系统。团队证实,经过功能化改造的单核细胞,能够主动进入并富集于阿尔茨海默病模型小鼠的大脑中(包括Tau蛋白沉积严重的区域如海马体和纹状体等),并结合核酸适体对Tau蛋白的特异性分子识别,高效吞噬脑脊液中的Tau蛋白。
这一干预措施抑制了小胶质细胞和星形胶质细胞的过度活化,减轻了神经炎症,保护了神经元和线粒体的完整性。无论是短期还是长期治疗,均能改善模型小鼠的记忆力和空间学习能力,且未观察到毒性或行为方面的副作用。
基于核酸适体的单核细胞疗法能够在阿尔茨海默病患病大脑中实现靶向递送、有效清除和持续的神经保护作用,为阿尔茨海默病的治疗干预提供了颇具前景的新策略。
相关研究发表在《自然-生物医学工程》(Nature Biomedical Engineering)上。
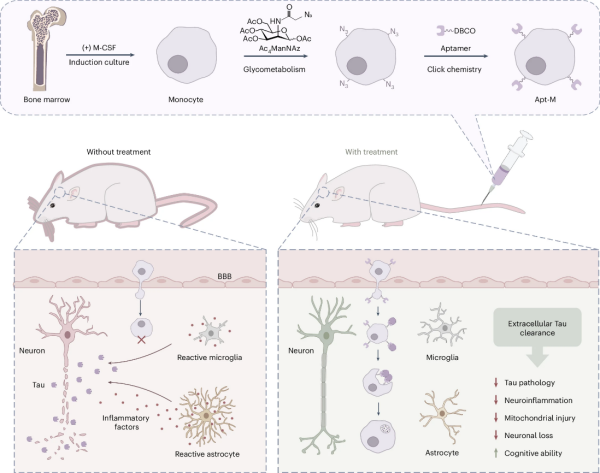
基于核酸适体的单核细胞疗法工作原理
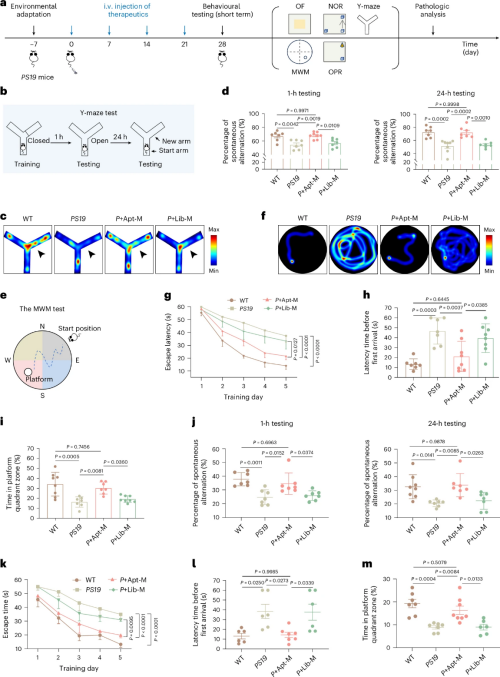
基于核酸适体的单核细胞疗法改善AD小鼠的记忆与认知
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...