细菌类组蛋白H-NS翻译后修饰研究取得进展
文章导读
细菌如何精准控制外来基因的“开关”?中国科学院南海海洋研究所王晓雪团队揭秘:类组蛋白H-NS通过翻译后修饰形成“分子密码”,调控基因沉默与激活。N端、C端及连接区的修饰分别掌控聚合状态、电荷分布与DNA结合能力,协同环境信号实现基因表达精准调控。更惊人的是,外源基因自身编码的修饰酶可主动破解H-NS的沉默,上演一场基因层面的“反向操控”。这一发现揭示了细菌适应环境、获取新功能的深层机制,为抗菌策略开发提供全新思路。
— 内容由好学术AI分析文章内容生成,仅供参考。
基因组压缩与动态调控是生命体共通的科学问题。细菌缺乏真核生物核小体结构,依赖H-NS等核结合蛋白实现基因组的压缩与调控功能。H-NS可沉默原噬菌体、毒力岛等外来基因元件,维持基因组稳定性。此前研究发现,细菌能在特定环境下解除H-NS的沉默并激活外源基因表达,这一过程是细菌环境适应的关键过程。但细菌宿主如何感应外界环境变化,通过H-NS实现对外来基因元件的精准调控,是领域内备受关注的科学问题。
中国科学院南海海洋研究所王晓雪团队,梳理了细菌类组蛋白H-NS的多种翻译后修饰模式,提出这些修饰模式构成“细菌类组蛋白密码”,揭示了H-NS通过翻译后修饰驱动细菌基因组进化的精密机制。
研究团队整合了大肠杆菌、铜绿假单胞菌、希瓦氏菌和杀鱼爱德华氏菌等多物种证据,阐释了H-NS蛋白通过其不同结构域发生多种翻译后修饰,以调控其沉默功能。具体而言,N端修饰通过调整H-NS的聚合状态,掌控基因沉默的开关;中间柔性连接区的修饰能够重塑电荷分布;C端修饰则直接改变其对高AT含量DNA的结合能力。
翻译后修饰是拮抗H-NS沉默的关键机制,与已知的抗沉默蛋白、小分子代谢物及蛋白酶解等途径协同作用。通过感知环境信号、传导调控指令,最终实现表型输出,助力细菌利用外源基因增强环境适应性。
研究进一步提出,外源基因常编码修饰酶或抗沉默蛋白,在激活条件下解除H-NS介导的基因沉默。这一由外来元件参与的主动“转录解抑制”过程,体现了细菌与外来基因元件间的竞争与协作关系,是认识微生物中水平基因转移的重要视角。
该研究为理解细菌环境适应、致病机制,以及开发新型抗菌策略提供了理论支撑。
相关研究成果发表在FEMS Microbiology Reviews上。
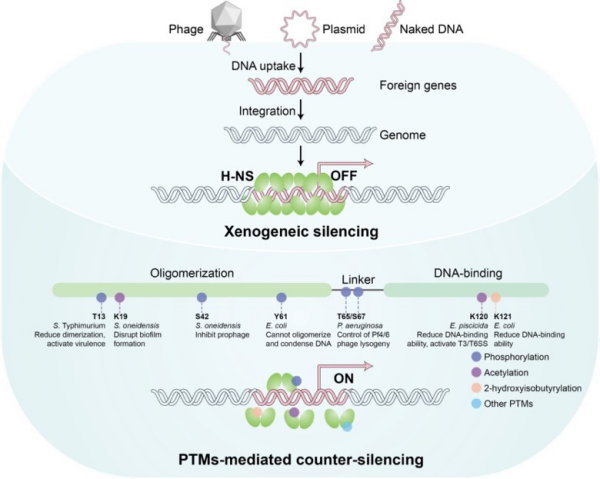
H-NS沉默外源基因表达与翻译后修饰介导抗沉默机制
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...