原癌基因MYC的小分子抑制剂研发获进展
文章导读
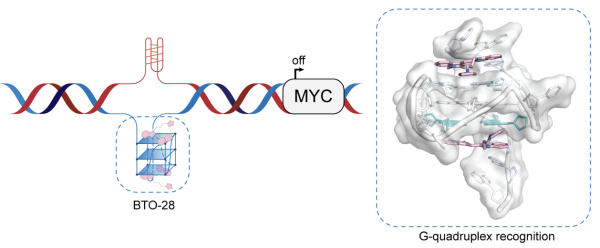
MYC基因在多种癌症中异常激活,却长期因“难以成药”而无药可医?中国科学院上海有机化学研究所曹春阳团队迎来突破:他们开发出新型小分子BTO-28,能精准靶向MYC基因启动区的G-四链体,通过独特结合模式稳定其结构,有效抑制MYC转录。这一发现不仅揭示了配体诱导G-四链体构象变化的新机制,更点燃了MYC靶向治疗的希望之火。抗癌新药的曙光,就此照亮?
— 内容由好学术AI分析文章内容生成,仅供参考。
原癌基因MYC在细胞增殖、代谢和分化等生物学过程中发挥关键作用,是人类肿瘤中常被激活的癌基因之一。长期以来,MYC被认为是颇具潜力但充满挑战的治疗靶点。目前,尚未有针对MYC驱动肿瘤的有效靶向药物。
近日,中国科学院上海有机化学研究所曹春阳团队,开发出新型苯并噻唑衍生物BTO-28,可抑制MYC表达。机制研究显示,BTO-28通过π–π堆积与外部G-四链体结合,并与5′和3′-端灵活的侧翼碱基相互作用,调整构象以维持稳定的结合。BTO-28可在体外及细胞内诱导并稳定MYC G-四链体,在基因组水平选择性抑制MYC的转录活性,同时抑制转录因子SP1与RNA聚合酶II在MYC启动子区域的结合。
上述研究报道了核酸碱基替代物与侧翼碱基之间的独特氢键模式,为探讨配体诱导的G-四链体结构变化如何调控复杂的转录过程提供了新见解,并为MYC驱动的肿瘤新靶向治疗药物开发提供了参考。
相关研究成果发表在《核酸研究》(Nucleic Acids Research)上。研究工作得到国家自然科学基金委员会、中国科学院、香港研究资助局等的支持。
原癌基因MYC的小分子抑制剂研发获进展
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...