中国农业大学动科学院韩红兵教授团队开发了CRISPR-Cas12i高效多重基因编辑工具
文章导读
基因编辑效率低、多重编辑难?中国农大韩红兵团队破解行业痛点!他们通过系统性优化CRISPR-Cas12i.3,成功开发出自主知识产权工具EOCas12i——编辑效率最高提升60倍,甚至超越SpCas9,且脱靶率更低。实测中,该工具轻松实现20-30个基因位点同步精准编辑,缺失片段更长,已成功培育多基因编辑绵羊。这项突破不仅解决了多基因调控网络研究的瓶颈,更为农业育种和基因治疗提供高效新平台,让复杂基因工程从实验室走向现实应用。
— 内容由好学术AI分析文章内容生成,仅供参考。
近日,动物科技学院韩红兵教授团队在国际权威期刊 《核酸研究》(Nucleic Acids Research)发表研究论文 《一种用于高效多重基因组编辑的工程化 CRISPR-Cas12i 工具》(An engineered CRISPR-Cas12i tool for efficient multiplexed genome editing)。该研究围绕前沿的 CRISPR 基因编辑技术,通过系统的工程化改造,成功开发出一种高效多基因编辑工具 EOCas12i,在多重基因组编辑应用中展现了良好效果。
高等生物通常依赖于基因调控网络精细控制细胞生理等过程。因此,多基因编辑工具开发,对于基础研究和基因工程的应用都具有重要意义。尽管多种CRISPR-Cas效应因子(如SpCas9、AaCas12b、AsCas12f和LbCas12g)具备核酸酶活性,但普遍缺乏独立加工前体crRNA(pre-crRNA)的能力,或在没有tracrRNA的情况下无法发挥作用。为此,通常需要引入额外的RNA调控元件(如tRNA或核酶)或异源蛋白(如Csy4)实现多基因编辑,在一定程度上限制了其在高效多重基因组编辑中的应用。
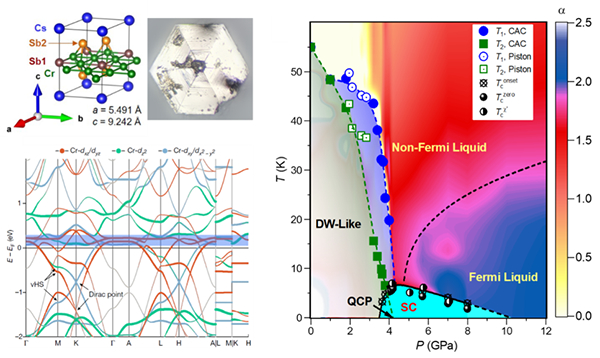
CRISPR-Cas12i.3是我校自主知识产权的基因编辑系统。Cas12i.3因体积相对较小(1,045个氨基酸)且PAM要求简单(5′-TTN)而备受关注。然而,已有研究显示其编辑效率较低。此前虽有通过蛋白质突变提升Cas12i.3编辑效率的尝试,但在关键优化策略方面—如crRNA设计、密码子优化以及外切酶融合等仍缺乏系统探索。值得注意的是, 已证明Cas12a在多重基因组编辑中效果显著,Cas12i.3在未经优化时缺乏pre-crRNA加工能力。基于两者的相似性,系统性优化Cas12i.3有望突破这一局限,使其成为一种更为紧凑且具潜力的多基因编辑工具。
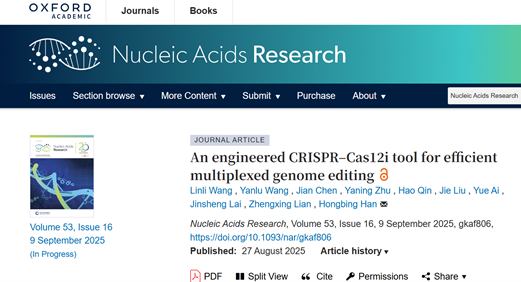
根据这一思路,该研究团队通过优化CRISPR RNA(crRNA)设计、密码子使用以及外切酶融合,构建了初步优化的Cas12i(initial optimized Cas12i,IOCas12i)系统。在此基础上,研究团队进一步开展理性设计与氨基酸突变,并通过区域组合开发出高效的增强型优化Cas12i(enhanced optimized Cas12i,EOCas12i)系统,即EOCas12i–Combo1和EOCas12i–Combo2。
通过多维优化组合构建高效EOCas12i系统。研究团队在HEK293T细胞中对八个代表性内源基因位点(ADRB2、CHRM4、FANCF、CXCR4、AR、CD2、GRIN2B和HBB)进行了深度靶向测序,以评估EOCas12i-Combo1和EOCas12i-Combo2的基因编辑能力。结果显示,两种变体在八个位点的平均插入缺失突变频率分别达到64.1%和66.6%,相较野生型Cas12i.3分别提高至2.5–22.8倍和3.0–60.0倍。在CHRM4、FANCF、CD2和HBB等位点,两种EOCas12i变体的编辑效率甚至超过SpCas9。总体而言,EOCas12i-Combo1和Combo2展现出强大且具竞争力的基因编辑性能。
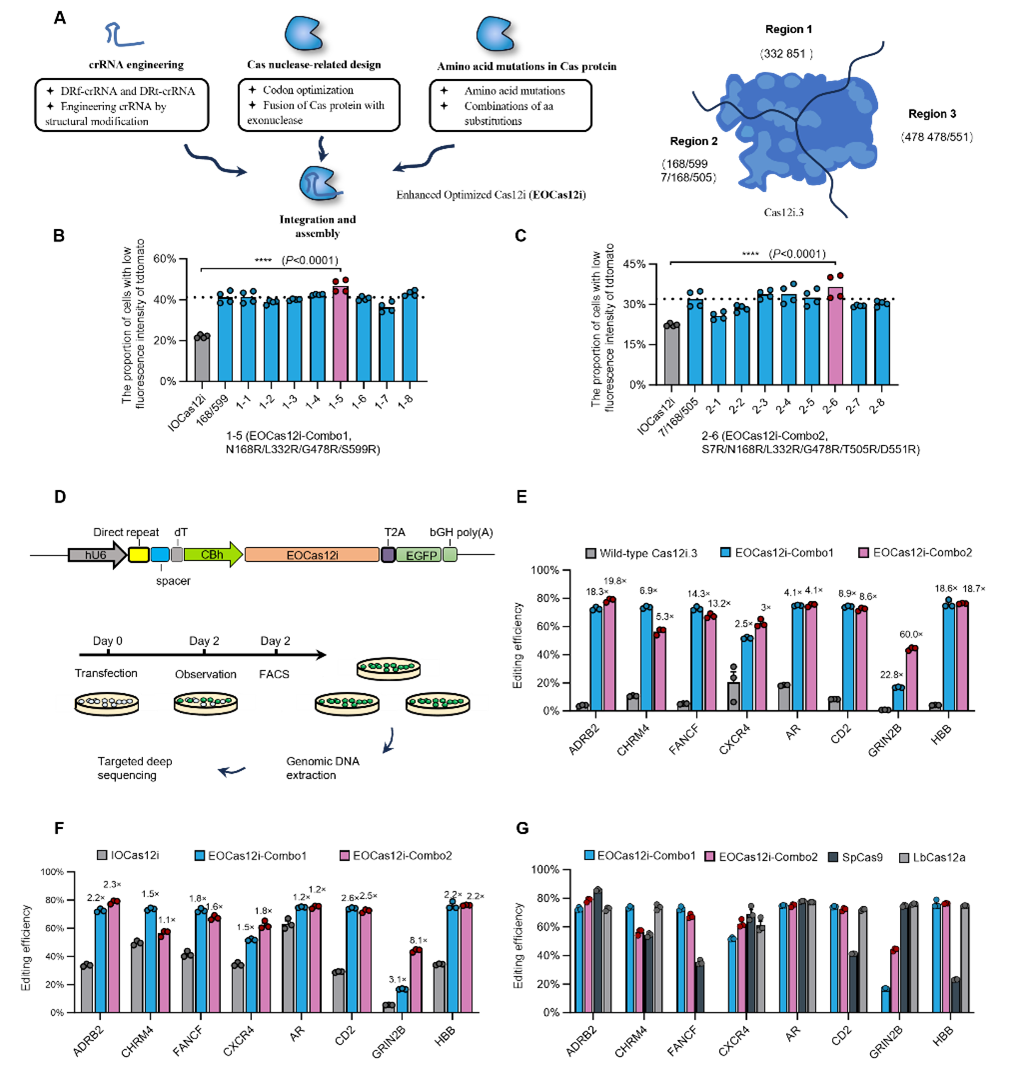
EOCas12i的功能特性。研究发现,IOCas12i和EOCas12i在多个基因位点诱导的缺失片段更大,主要集中在11–40 bp,而Cas12i.3、SpCas9和LbCas12a的缺失多在10 bp以内,尤其是SpCas9。进一步的GUIDE-seq分析表明,在ADRB2位点三者脱靶情况相似,而在CXCR4位点,SpCas9的脱靶次数明显高于EOCas12i-Combo1和Combo2,显示EOCas12i可能具有更好的特异性。为了验证其在动物中的应用,研究团队将EOCas12i-Combo2的mRNA和crRNA显微注射到小鼠受精卵中,移植65枚胚胎后共获得10只幼鼠。结果显示,其中4只(40%)出现了DNMT1位点的插入缺失突变。以上结果证明,EOCas12i表现出较高的特异性,并产生更长的插入缺失,并能够用于基因编辑动物制备。
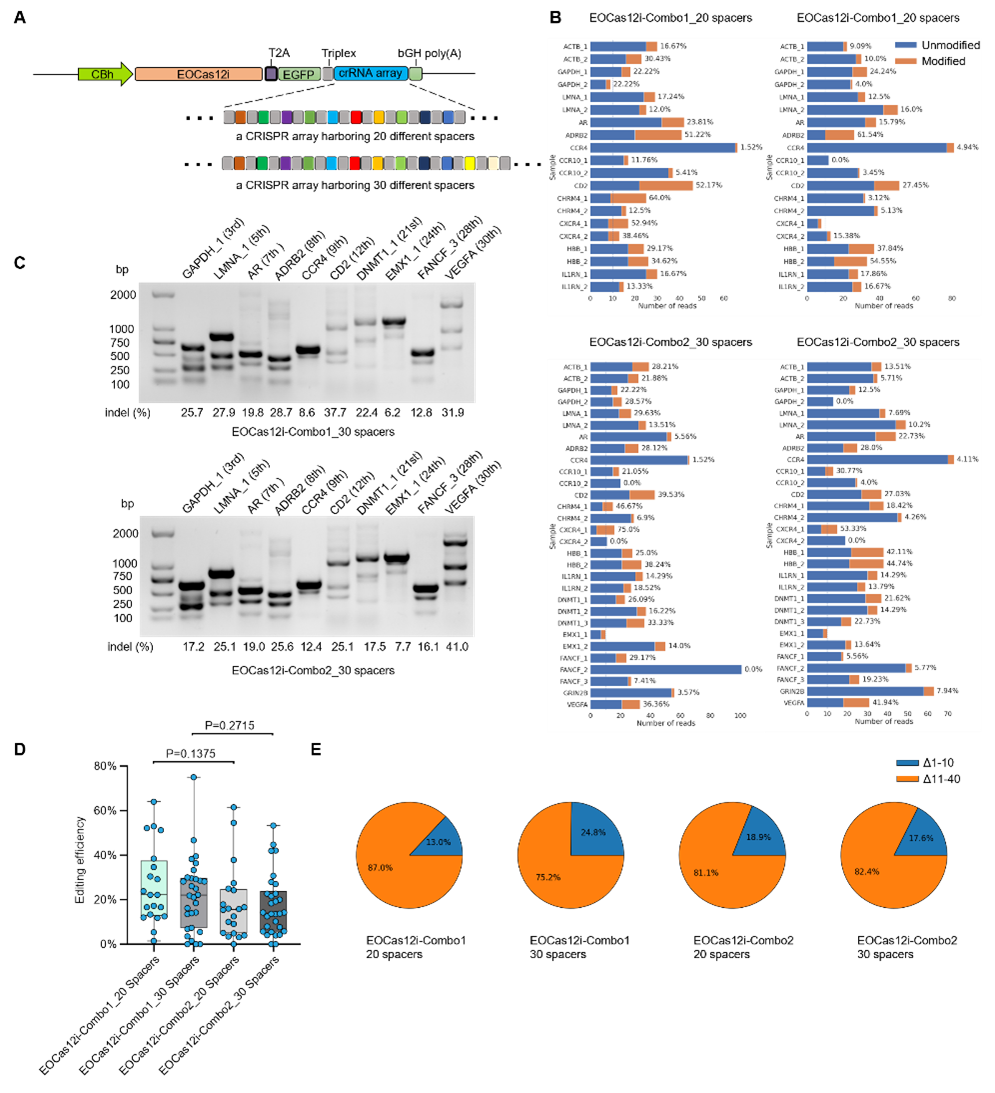
基于EOCas12i的多重基因组编辑开发。研究团队使用两种CRISPR阵列评估了EOCas12i平台的多重基因组编辑能力:一个20靶点阵列和一个30靶点阵列,分别覆盖12个和17个内源基因位点。结果显示,无论使用20靶点还是30靶点阵列,EOCas12i-Combo1和Combo2在所有靶点均表现出高效编辑,且多靶点编辑主要产生大于10 bp的缺失片段,与单基因编辑的情况一致。总之,EOCas12i-Combo1和Combo2均可实现高效多重基因组编辑。
团队通过本研究申请了国内发明专利5件,国际PCT专利1件,开发的基因编辑系统具有完全自主知识产权。另外,利用该基因编辑系统获得了多基因编辑绵羊,预期EOCas12i–Combo1和EOCas12i–Combo2将成为多重基因组编辑应用的新型高效平台。
中国农业大学动科学院博士后汪林丽为论文独立第一作者,中国农业大学动物学院韩红兵教授为论文唯一通讯作者。中国农业大学已毕业硕士王岩露,在读博士生朱亚宁、秦浩、刘洁和博士后艾越参与了该项研究工作。中国农业大学农学院赖锦盛教授和陈建副教授提供了原始Cas12i.3系统并在研究思路上给予了大力支持。该研究得到了农业生物育种重大专项(2022ZD04013)、内蒙古自治区科技突围项目(2025KJTW0022)、中国农业大学基本科研业务费专项资金项目(2022TC025)以及拼多多-中国农业大学研究基金(PC2023A01004)的资助。
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...