研究发现氧化型左旋核酸可作为ZBP1新型配体并驱动阿尔茨海默病神经炎症
文章导读
阿尔茨海默病的神经炎症根源竟藏在DNA氧化断裂中?最新研究颠覆认知:氧化型左旋核酸(Z-DNA)被证实是ZBP1的新型内源性配体!中国科学家首次揭示,在患者大脑中,氧化应激导致线粒体DNA断裂并形成特殊左旋结构,激活ZBP1-RIPK1通路,同时引爆I型干扰素、TLR和NLRP3三条促炎"火线",直接驱动神经损伤。更关键的是,靶向阻断该通路可显著缓解Aβ沉积与认知衰退——这项发表于《免疫》的突破,不仅破解了AD神经免疫调控的核心机制,更为治疗提供了全新靶点:抑制ZBP1或RIPK1活性,或将成为逆转疾病的关键钥匙。
— 内容由好学术AI分析文章内容生成,仅供参考。
阿尔茨海默病是未被攻克的神经退行性疾病,以Aβ斑块和tau神经纤维缠结为主要病理特征。
此前研究发现,小胶质细胞介导的神经炎症在阿尔茨海默病发生发展中起到重要作用。小胶质细胞在阿尔茨海默病中,被Aβ过度持续激活,引发慢性炎症,加剧tau病理、星形胶质细胞活化及神经元损伤死亡。I型干扰素、TLR信号通路、NLRP3炎症小体等信号通路,被发现参与驱动这一过程,但它们之间的功能联系尚不明确。
左旋核酸Z-DNA是非经典DNA结构,可通过先天免疫受体ZBP1激活免疫反应,在抗病毒及炎症调控中发挥关键作用。左旋核酸配体的鉴定,成为领域内的核心科学问题。此外,有研究发现阿尔茨海默病患者大脑存在Z-DNA,但其形成机制、病理功能及ZBP1介导的识别机制的作用仍然未知。
近日,中国科学院上海有机化学研究所许代超研究团队揭示,氧化断裂的Z型线粒体DNA,可作为ZBP1的新型内源性配体,并驱动小胶质细胞介导的神经炎症过程。这一发现为探讨左旋核酸感知以及阿尔茨海默病神经免疫调控机制提供了新视角。
研究发现,在阿尔茨海默病病理环境下,氧化应激导致线粒体DNA的鸟嘌呤发生氧化并形成8-oxoG,随后DNA断裂,通过mPTP-VDAC通道释放至细胞质中。这些断裂的线粒体DNA富含8-oxoG可发生构象转变,形成非经典的左旋Z型结构(Z-DNA)。这类氧化型Z-DNA可被ZBP1特异性识别,进而通过招募RIPK1并激活其激酶活性,同时促进I型干扰素、TLR信号和NLRP3炎症小体等多条促炎通路,导致神经炎症和阿尔茨海默病相关病理变化。
研究进一步在阿尔茨海默病模型中发现,敲除ZBP1或抑制RIPK1活性,可缓解神经炎症、Aβ沉积和行为缺陷。这不仅确立了Z-DNA–ZBP1–RIPK1轴在阿尔茨海默病神经炎症中的核心作用,也阐明氧化应激产生的内源性Z-DNA是激活该通路的关键分子。
上述研究揭示氧化型左旋核酸可作为ZBP1的新型配体,突破以往ZBP1主要识别外源病原体核酸或未修饰内源核酸的认知,为阿尔茨海默病免疫机制研究提供了新视角。同时,这一发现对氧化应激相关的其他人类疾病的机制研究与治疗策略具有启示意义。
9月2日,相关研究成果在线发表在《免疫》(Immunity)上。研究工作得到科技创新-2030重大专项、国家自然科学基金、中国科学院相关项目等的支持。
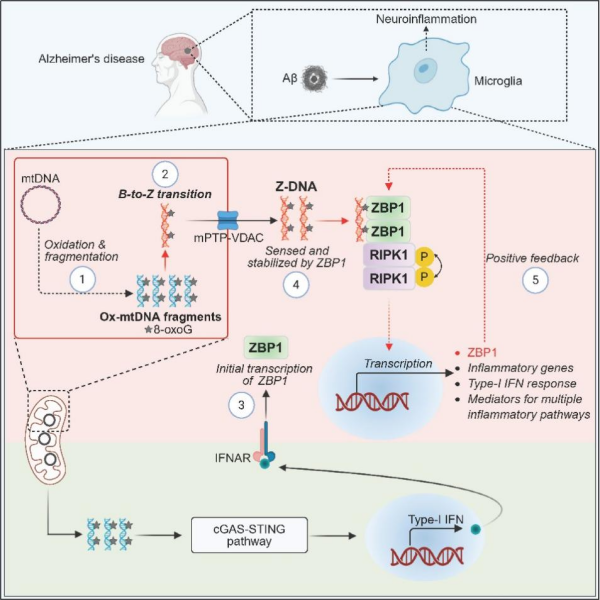
新型氧化型左旋核酸的产生及其在阿尔茨海默病神经炎症中的作用机制模型
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...