文章导读
你是否好奇大脑如何在饥饿与饱腹间瞬间切换动机状态?南京大学生命科学学院景键/张果团队联合鹏城实验室、电子学院,首次揭示胆囊收缩素(CCK)的精准调控机制:它通过协调摄食神经环路的突触可塑性与神经元内在特性,实现从“狼吞虎咽”到“停止进食”的快速转换。研究发现,海兔CCK与哺乳动物高度保守,作为“饱肽”减少摄食,并解析了其分子与环路基础。这一突破为肥胖、厌食症等代谢疾病提供了全新干预靶点,发表于Cell Reports期刊。
— 内容由好学术AI分析文章内容生成,仅供参考。
从“狼吞虎咽”到“停止进食”,大脑是如何在饥饿与饱腹之间实现如此复杂的动机切换的?
近日,南京大学生命科学学院景键/张果团队,携手鹏城实验室于全团队、南京大学电子科学与工程学院周海波团队,首次揭示胆囊收缩素(cholecystokinin,CCK)通过精确调控摄食环路中特定神经元的内在特性与突触可塑性,实现摄食动机的快速转换。这一发现为肥胖、厌食症等代谢疾病的干预提供了全新思路。相关成果于2025年7月22日在线发表在 Cell Reports。
动机转换的科学之谜
动机状态的转换及其伴随的多种行为变化,是包括人类在内的双侧动物生存活动的核心特征。以饥饿到饱腹为例,摄食行为通常依次经历“主动进食”“拒斥食物”直至“完全停止”的渐进式转变。然而,这一过程中神经环路与突触层面的精确调控机制,长期未被系统阐明。
本研究团队以软体动物海兔(Aplysia)为模式动物,依托其已明确的摄食神经环路,结合分子生物学、质谱、行为学、细胞生物学及神经电生理等多学科技术,取得了以下三项突破:
三大核心发现
1.原口动物中CCK的保守性分布
在海兔中首次鉴定出多种磺酸化形式的成熟CCK神经肽,其分布同时存在于肠道与中枢神经系统,形态特征与哺乳动物的“脑肠肽CCK”高度保守。相比之下,原口动物另一大门—节肢动物中—与CCK同源的sulfakinin虽同样抑制摄食,却仅分布于中枢,与哺乳动物模式不一致。
2.功能上的跨物种保守性
行为学与离体环路实验表明,海兔CCK与哺乳动物CCK一样,均属于“饱肽”(satiety peptide)。海兔CCK可显著减少摄食量,并在离体运动程序中再现“进食→拒斥→停止”的顺序变化,模式与哺乳动物一致。此外,海兔肠道CCK细胞经肠神经投射至中枢,刺激肠神经可诱发中枢CCK释放。
3.动机转换的神经环路与突触机制
在高阶神经元主导的“摄入”程序中,CCK调控关键中间与运动神经元之间的突触可塑性占主导地位;在肠神经诱发的“拒斥”程序中,则通过协同调控神经元内在特性与突触可塑性共同作用。单细胞转录组测序进一步证实,靶标神经元表达CCK受体,揭示了其分子作用基础。
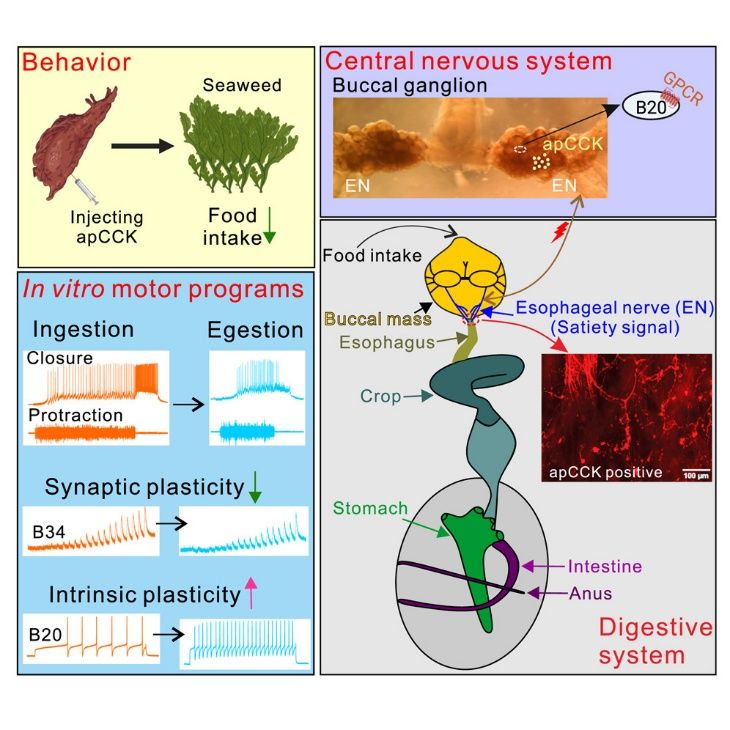
模式图:海兔CCK(apCCK)通过调控摄食环路神经元的突触与内在可塑性,诱导饱腹动机状态。
研究意义与展望
该研究首次证实软体动物海兔CCK与脊椎动物CCK在形态分布与功能上均高度保守,并借助海兔这一神经环路清晰的优势模型,系统解析了CCK介导动机状态转换的环路、突触及分子机制。这不仅为理解包括哺乳动物在内的摄食动机调控提供了新视角,也为肥胖、厌食症等代谢疾病的精准干预提供了潜在靶点。
论文信息
题目:Synaptic and intrinsic plasticity mediated by CCK type signaling coordinates behavioral changes during motivational state shifts期刊:Cell Reports(2025年7月22日在线发表)原文链接:https://www.cell.com/cell-reports/fulltext/S2211-1247(25)00820-4
作者团队
南京大学生命科学学院助理研究员张果、博士生丁雪莹,美国伊利诺伊大学厄巴纳–香槟分校助理教授Elena V. Romanova为共同第一作者;景键教授、于全院士、周海波教授及张果助理研究员为共同通讯作者。美国西奈山医学院Cropper教授、伊利诺伊大学厄巴纳–香槟分校Sweedler教授及内布拉斯卡大学Checco教授团队对本研究提供了重要支持。研究得到国家自然科学基金专家推荐类原创探索计划、面上项目、医药生物技术全国重点实验室以及美国国立卫生研究院基金等资助。
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...