研究揭示雄激素通过选择性多聚腺苷酸化调控肿瘤进展新机制
文章导读
雄激素如何“操控”前列腺癌进展?科学家首次揭示其通过选择性多聚腺苷酸化(APA)缩短关键基因3'UTR,逃避免疫抑制、加速肿瘤生长的新机制。研究发现,二氢睾酮(DHT)可诱导FASN等脂质代谢基因3'UTR缩短,提升蛋白表达,促进癌细胞增殖;临床样本证实,晚期患者中该现象显著增强。这一发现为前列腺癌治疗提供了全新靶点,或开辟“阻断APA”疗法的可能。
— 内容由好学术AI分析文章内容生成,仅供参考。
前列腺癌是男性常见的恶性肿瘤之一,雄激素在其发生发展中扮演关键角色。选择性多聚腺苷酸化(APA)作为一种重要的转录后调控机制,通过选择不同的多聚腺苷酸位点(PASs)改变mRNA的3′非翻译区(3’UTR)长度,影响基因表达。癌细胞常通过APA缩短3’UTR以逃避微小RNA(miRNA)的抑制,进而上调癌基因表达,但雄激素如何通过APA调控前列腺癌进展的具体机制仍有待探索。
中国科学院昆明动物研究所研究员、中国科学院院士张亚平团队联合云南大学、昆明医科大学第一附属医院研究团队揭示了雄激素二氢睾酮(DHT)调控前列腺癌的新机制。
研究以雄激素依赖型前列腺癌细胞系LNCaP为模型,结合PacBio单分子长读测序和Illumina RNA测序技术,首次绘制了DHT处理后的3’UTR全景图,发现DHT处理后细胞内APA事件整体增加。进一步分析显示,同时发生表达变化和APA改变的基因主要富集于脂质代谢相关通路,如FASN、ACSL3等。这些基因在DHT刺激下倾向于使用近端PASs,导致3’UTR缩短。机制研究表明,缩短的3’UTR缺失了miRNA的结合位点,使其逃脱miRNA的抑制,最终上调蛋白质表达。
为验证关键基因缩短的功能,研究团队利用CRISPR/Cas9技术构建了FASN基因远端PAS缺失的前列腺癌细胞系22RV1-FS。结果显示,22RV1-FS细胞中FASN表达显著上调,体外增殖能力增强,且在裸鼠体内的成瘤能力显著提升。临床样本分析进一步支持了这一机制:与良性前列腺增生相比,晚期前列腺癌和去势抵抗性前列腺癌患者的FASN转录本中3’UTR缩短的比例显著升高,提示近端PAS的使用与疾病进展密切相关。
相关研究成果以Androgen induces 3’UTR shortening of de novo lipogenesis genes by alternative polyadenylation in prostate cancer cells为题,发表在《中国科学:生命科学》(SCIENCE CHINA Life Sciences)上。研究工作得到国家自然科学基金、云南省重点研发计划等的支持。
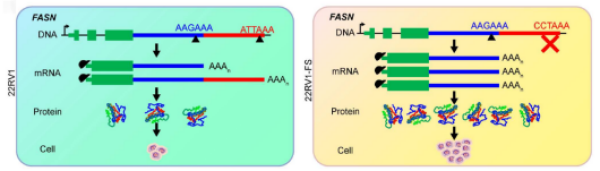
FASN基因APA改变与细胞增殖活性关系示意图
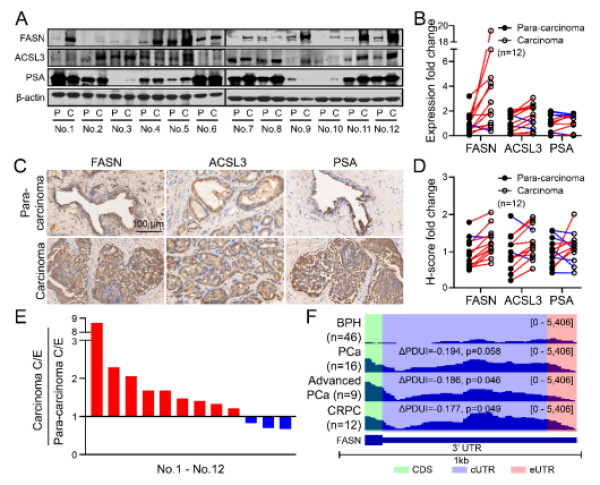
癌组织倾向于使用FASN基因近端的PAS
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...