文章导读
南京大学研究团队首次揭示了高分子在细胞膜脂筏上扩散的全新物理规律:一种基于分子尺寸和粘滞阻力的“双模式切换”机制。这一发现颠覆了传统认知,不仅揭示了高分子如何调控脂筏聚散、影响细胞信号传导,也为阿尔兹海默症等疾病的膜靶向治疗提供了关键理论支撑。通过前沿模拟与实验结合,研究清晰呈现了高分子链如何在细胞膜“乘风破浪”,为生物物理领域带来突破性见解。
— 内容由好学术AI分析文章内容生成,仅供参考。
南京大学匡亚明学院胡晶磊副教授联合化学化工学院胡文兵教授及合作者,在高分子与细胞膜相互作用机制方面取得重要进展。
生物高分子在细胞膜上的吸附与扩散对于信号转导及包括阿尔兹海默症在内的多种疾病的发生机制至关重要。然而,由于膜异质性、大分子构象以及流体力学作用之间的复杂耦合,研究这一过程面临极大的挑战。研究团队通过大尺度流体力学模拟,结合单分子示踪实验,揭示了高分子与细胞膜相互作用的新规律,为高分子—生物膜相互作用提供新见解。该研究表明,高分子吸附物可被用于调控膜蛋白簇集与信号传导以及免疫突触等脂筏相关的细胞过程。研究成果对生物物理学和生物技术领域具有重要意义,尤其是在理解细胞膜的组织行为和推动膜靶向治疗方法的应用方面。
高分子在脂筏上的扩散遵循新标度律
当吸附高分子受限于膜内脂筏的动态约束时,其扩散系数呈现新的标度关系D ∼ N−νD, 其中νD ≈ 0.5(图1)。由细胞质或细胞外液吸附到脂筏上的纳米尺寸的生物高分子也将遵循该标度关系。这一纳米尺度且生物相关的物理区域由以下两个特征长度所决定:一是Saffman-Delbrück 长度 ℓSD(约10–100 nm),二是高分子能够诱导脂筏形成所需的最小尺寸ℓc(约1.8 nm)。
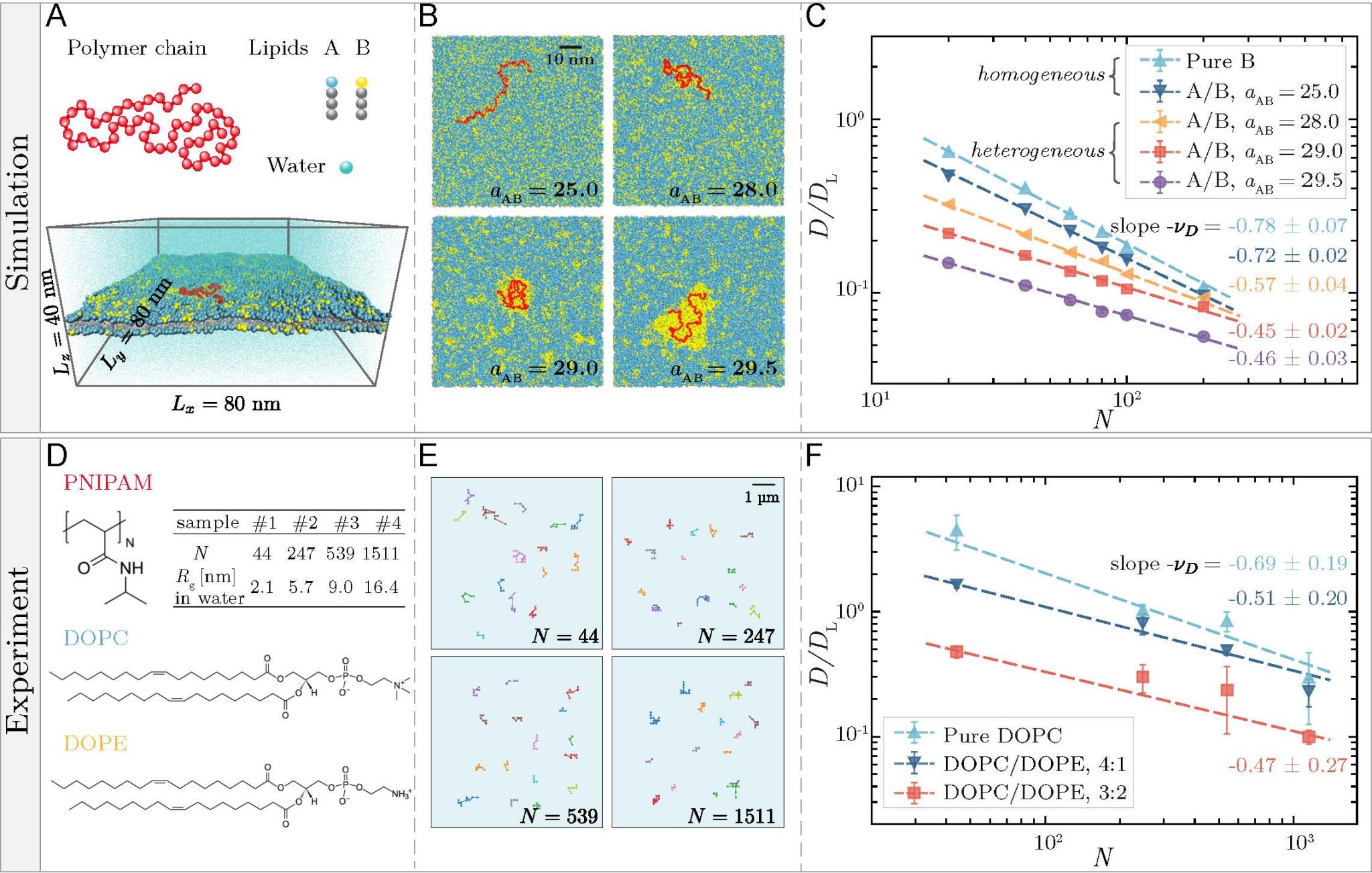
图 1:大尺度流体力学模拟与单分子示踪实验揭示高分子在异质膜上的新扩散规律。
吸附高分子对脂筏具有调控作用
在A相基质(天蓝色)中,B型脂质团簇(以不同颜色区分)在膜上持续发生融合与裂解,导致团簇的大小和形状不断变化。吸附高分子链(红色)能感知周围B型脂筏(黄色)的分布,并动态调整自身构象(图 2a)。从膜生物物理学的角度来看,当高分子的吸附能足够抵消脂质混合熵和自身构象熵的损失时,它可作为“高分子胶水”,将多个小脂质簇聚合成较大的、与其共定位的脂筏。反过来,这些脂筏又对高分子施加“软限域”约束,使其在膜面呈现出溶胀但受限的二维构象特征(图2c-d)。
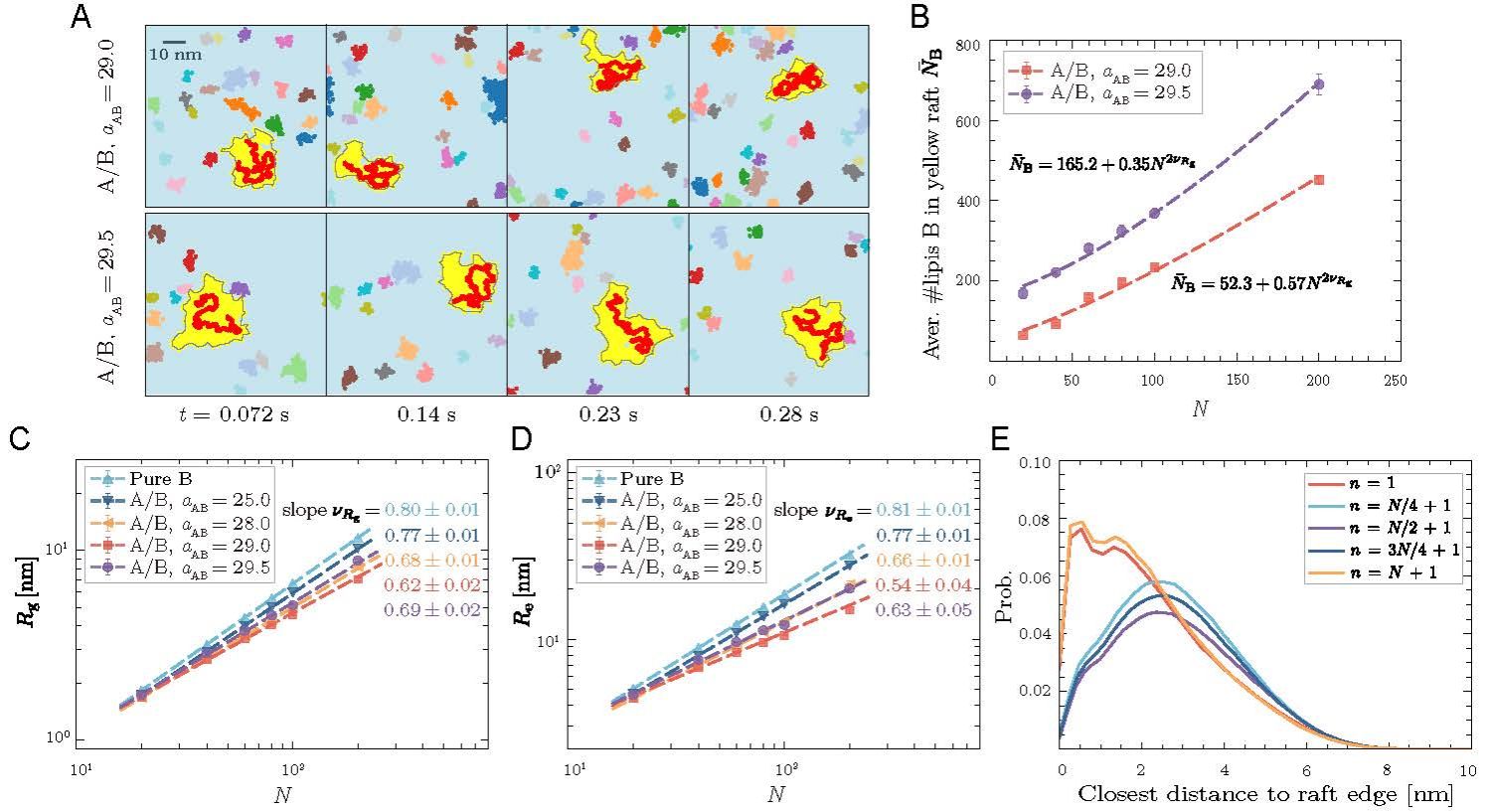
图 2:大尺度流体力学模拟揭示吸附高分子链促进脂筏的形成,而脂筏反过来影响高分子链的构象行为。
高分子在膜上呈现两种扩散模式
跨膜蛋白一类的膜内嵌物的扩散是膜生物物理学中的核心概念,对理解膜的结构与功能具有重要意义。人们普遍认为,附着或嵌入膜中的生物大分子表现出类似于跨膜蛋白的Saffman-Delbrück扩散模式。然而,吸附在膜表面的高分子链在扩散过程中会根据其与溶剂(P–S)和与膜(P–M)之间的粘滞阻力的差异呈现出Stokes-Einstein与Saffman-Delbrück两种模式。具体来说:当 P–S 摩擦占主导时,高分子作为三维物体在溶液中扩散,遵循 Stokes-Einstein关系;当 P–M 摩擦占主导时,高分子表现得类似于膜内嵌物,其扩散行为符合Saffman-Delbrück模式。这一发现为理解二维膜与三维溶剂流体如何共同调控膜上纳米尺度物体的扩散提供了新的视角(图3)。
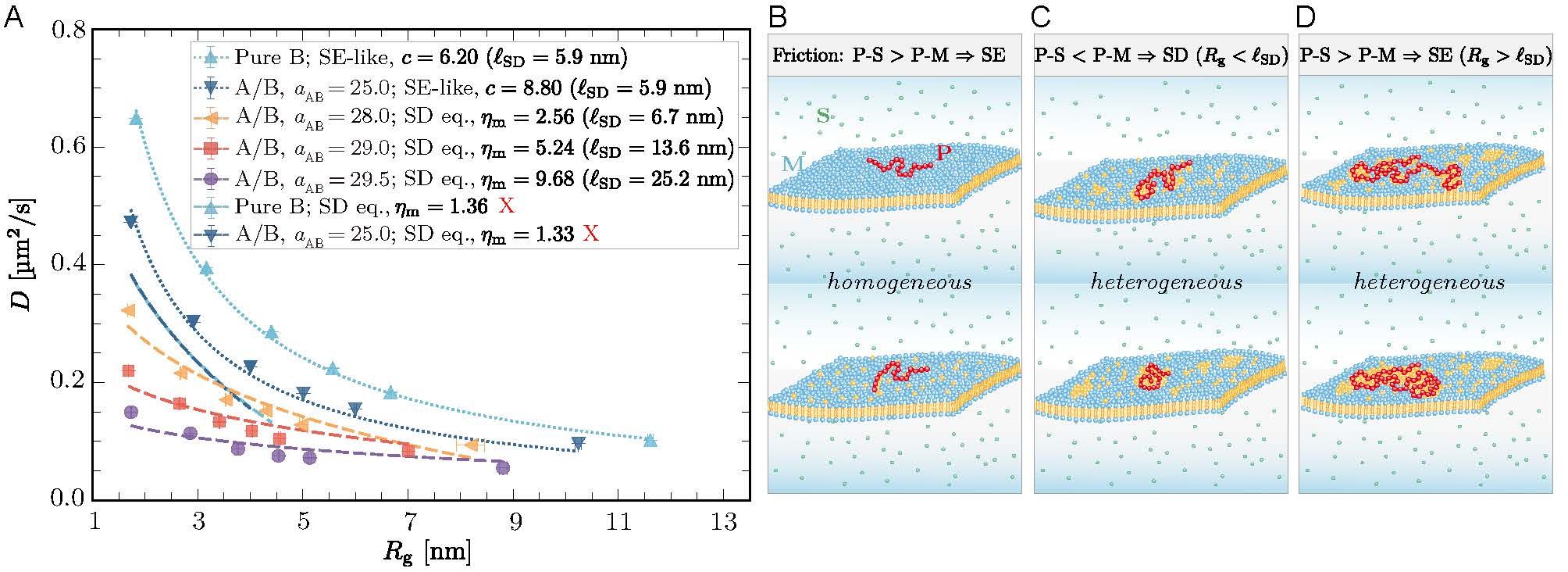
图 3:大尺度流体力学模拟揭示高分子在脂质膜上扩散的尺寸依赖性及相应的物理图像。
研究成果以“Polymer sailing on rafts within lipid membranes”为题,于2025年7月3日发表在《美国科学院院刊》上。南京大学胡晶磊课题组的博士生高洁为论文第一作者,化学拔尖班本科生沈祎杨为第二作者。中国科学院温州研究院好村滋行(Shigeyuki Komura)教授提供了富有启发性的讨论并参与论文修改。南京大学胡文兵教授在数据分析和论文写作方面提供了重要指导,武汉理工大学沈雷教授负责单分子示踪实验,他们为论文的共同通讯作者。胡晶磊副教授构思并设计了整个研究项目,是论文的最后通讯作者。本研究得到国家自然科学基金重点和面上项目以及国家重点研发计划的资助。大尺度流体力学模拟工作在南京大学高性能计算中心完成。
原文链接:https://doi.org/10.1073/pnas.2503203122。
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...