文章导读
溶血发生时,体内如何快速清除有毒的血蛋白?北京大学晓东团队揭晓关键受体CD163的“工作密码”。225年7月21日,《自然·通讯》其最新成果:冷冻电镜解析CD163识别Hb–Hp复合物的三维结构,首次揭示该受体依赖钙离子形成寡聚体的分子机制。研究发现,CD163通过不同结构域分别负责“识别敌人”与“自我组装”,而这种钙离子调控的寡聚化直接影响其内吞效率。这一发现为理解免疫清除机制提供了全新视角,也为相关炎症疾病治疗开辟潜在路径。
— 内容由好学术AI分析文章内容生成,仅供参考。
CD163是一种I型跨膜糖蛋白,主要表达于M2型单核/巨噬细胞表面,属于清道夫受体富含半胱氨酸结构域(Scavenger Receptor Cysteine-Rich, SRCR)超家族B类成员。作为重要的免疫调节受体,CD163在维持体内稳态、调控炎症反应及清除有害分子等过程中发挥着重要作用。
在血管内外发生溶血时,红细胞释放的游离血红蛋白(hemoglobin, Hb)具有显著毒性,尤其是其所含铁离子易引发氧化损伤。血浆中的结合珠蛋白(haptoglobin, Hp) 可迅速与Hb结合,形成Hb–Hp复合物。CD163作为目前已知的该复合物专一识别受体,介导Hb–Hp复合物的内吞从而降解为胆绿素、游离铁和一氧化碳等产物,完成解毒过程。
2025年7月21日,生命科学学院苏晓东教授团队在《自然·通讯》(Nature Communications)杂志发表题为“Calcium-dependent oligomerization of scavenger receptor CD163 facilitates the endocytosis of ligands”的研究论文,报道了CD163识别Hb–Hp复合物的三维结构,并揭示了其依赖钙离子的寡聚化机制,为理解该受体的配体识别与内吞功能提供了重要的结构基础。

论文截图
论文的第一兼通讯作者、实验室博士后徐华通过冷冻电镜技术解析了CD163识别Hb-Hp的三维复合物结构,发现HEK293细胞表达的CD163蛋白分子在复合物中形成了不同的寡聚体,分别以二聚体和三聚体形式结合配体;进一步通过分子筛(SEC)以及分析性超速离心(AUC)分析,发现CD163的寡聚化依赖钙离子浓度调控,并且能以单体、二聚体和三聚体形式存在,随着钙离子浓度升高,三聚体的占比也随之增大。
结构分析显示,CD163通过N端的SRCR2-4结构域介导Hb-Hp复合物的识别,而C端的SRCR5-9结构域则介导其自身的寡聚化。这些过程均依赖SRCR结构域中富含酸性残基的钙离子结合位点(acidic cluster),通过与底物或CD163分子中富碱性的赖氨酸区域形成稳定相互作用,实现功能性寡聚。
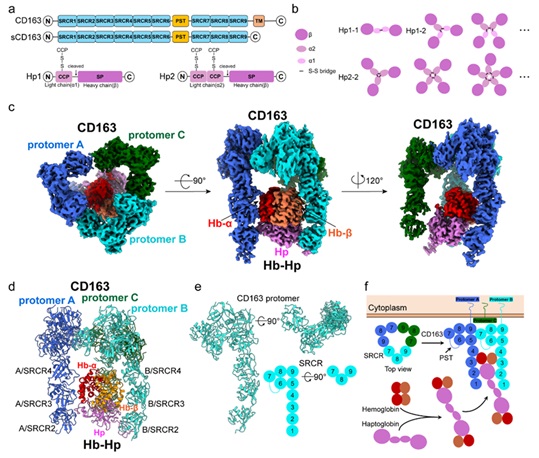
CD163结合配体Hb-Hp复合物的冷冻电镜结构:CD163、Hb以及Hp蛋白的结构域组成和Hp蛋白不同亚型的寡聚化(a、b),三聚体CD163结合Hb-Hp复合物的电子密度图以及结构模型(c—f),其主要通过两条CD163蛋白链的N端SRCR结构域识别配体,C端SRCR5-9结构域介导寡聚化形成三聚体
研究者们后续通过流式以及成像分析发现,当把CD163形成寡聚体的关键氨基酸突变后,CD163介导的Hb-Hp结合以及内吞效率大大降低,表明这种寡聚化机制对CD163的生理功能有着很重要的意义。
苏晓东和徐华是本文的共同通讯作者,徐华和生命科学学院博士生宋晓慧是本文的共同第一作者。
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...