山东大学刘新泳/展鹏教授团队发现新一代高效抗耐药性的抗艾滋病候选药物
近日,药学院刘新泳/展鹏教授团队在国际期刊Science子刊Science Advances,以“Development of enhanced HIV-1 non-nucleoside reverse transcriptase inhibitors with improved resistance and pharmacokinetic profiles”为题发表最新抗艾滋病药物研究成果。山东大学副研究员汪昭、教授康东伟、毕业研究生Samuel Desta Guma,美国罗格斯大学Shawn Rumrill为本文的第一作者,山东大学教授展鹏、刘新泳,美国罗格斯大学副教授Francesc Xavier Ruiz、教授Eddy Arnold,美国杜克大学教授Chin Ho Chen为本文的通讯作者,山东大学药学院为第一作者和通讯作者单位。

病毒感染严重危害人类的生命与健康。抗病毒药物的研发是控制和预防病毒性疾病的关键,病毒耐药问题始终是抗病毒药物治疗面临的严峻挑战,研发高效抗耐药性的抗病毒药物成为全球公共卫生与健康领域的重大需求。艾滋病是一种由人类免疫缺陷病毒(HIV)感染引起的严重传染病。目前全球共有约3990万HIV感染者,而我国现有约135.5万人感染HIV,每年新发现的HIV感染人数仍旧持续上升。然而目前的抗艾滋病药物大多存在疗效低、副作用大和患者耐受性差等诸多问题。因此,以临床重大需求为牵引,立足于原创药物研究,着力推动新型高效低毒的抗艾滋病创新药物的研发,具有重要的战略意义。
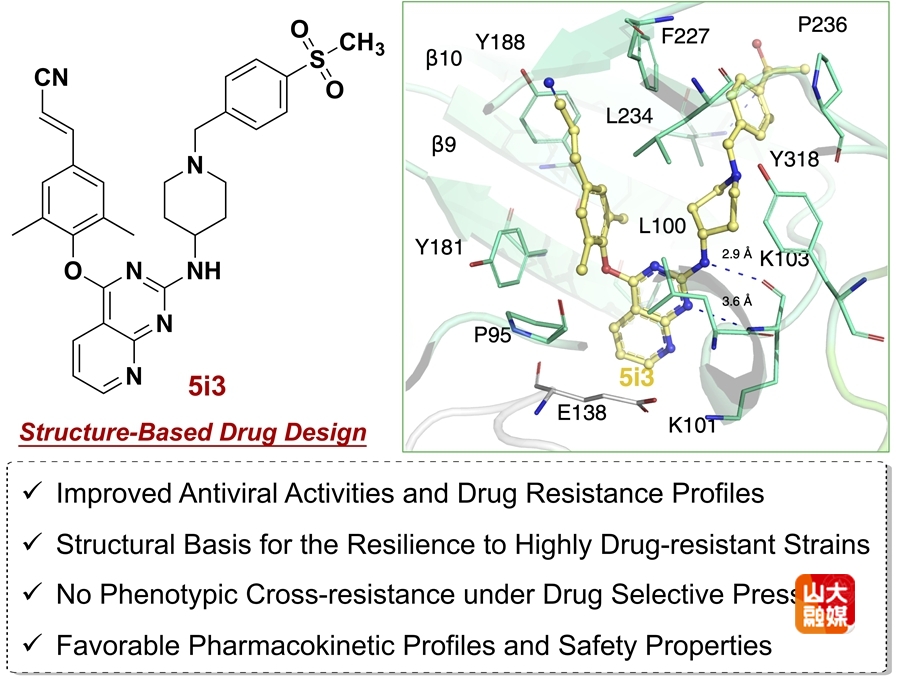
基于靶标的药物设计与新型高效抗耐药性的抗艾滋病候选药物5i3的发现
本研究聚焦于抗HIV药物的耐药性和安全性等科学问题,以“研发安全高效抗耐药性的抗艾滋病候选药物”为目标,运用基于靶标结构的合理药物设计策略,对先导化合物和上市药物进行全面结构改造,通过构建高品质聚焦化合物库来克服柔性靶标变构结合的难预测性,经过活性测试、结构生物学研究和初步成药性评价等工作,发现了抗耐药性与成药性俱佳的抗艾滋病候选化合物5i3。其对HIV-1野生株及多种临床耐药株均具有高效广谱的抗病毒活性(EC50 = 1.16~18.3 nM),5i3对临床三突变耐药株GH9(K101P+K103N+V108I)的活性是利匹韦林的153倍,对其余NNRTI多重耐药株的抗病毒活性是依曲韦林与利匹韦林的3~28倍,远优于最新一代的上市药物依曲韦林与利匹韦林。
结构生物学对于了解耐药性的产生机制和抗耐药性药物设计具有重要意义。本研究首次成功培养并解析了三突变GH9逆转录酶和小分子的复合物晶体结构,结构生物学研究表明5i3通过“顶端抬升”效应能够诱导结合位点的口袋扩张和结构重排,允许其通过构象灵活性和位置适应性而在突变后的口袋内形成新的氢键网络,同时保持与疏水通道和蛋白-溶剂界面区域的相互作用力,从原子水平阐明了5i3相比于利匹韦林具有高效抗耐药性的作用机制,为本领域后续修饰提供了坚实的结构生物学基础。
初步成药性评价结果表明5i3不仅表现出良好的体内安全性,还具备优异的药代动力学性质,口服生物利用度达到59.9%,显著优于上市药物。值得一提的是,药物选择性压力试验及表型交叉耐药性研究发现,5i3与利匹韦林和多种NRTIs药物之间未显示出交叉耐药,支持协同联合用药来进行抗病毒治疗。因此,5i3是值得开发的优质候选药物,未来可作为HAART疗法组分与其他NRTIs联用治疗艾滋病。
综上所述,本研究立足临床重大需求,综合运用药物化学策略、结构生物学信息以及计算机辅助药物设计等多学科交叉的设计理念,成功发现了结构新颖、具有高效抗耐药性的抗艾滋病候选化合物5i3,有望为我国开发具有自主知识产权和市场竞争力的抗艾滋病新药。该研究工作是刘新泳/展鹏教授团队多年来抗艾滋病药物研究工作的延伸与深化,得到国家自然科学基金、“重大新药创制”国家科技重大专项、山东省自然科学基金、美国国立卫生研究院基金等项目的资助。
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...