文章导读
你是否想过,精准捕捉药物与细胞受体之间的“分子对话”竟能如此直观?西安交大王嗣岑、解笑瑜教授团队揭开了药物作用机制的新篇章——他们构建了一种名为CDCSA的创新检测平台,首次实现对HGF/c-Met信号通路中受体二聚化与VEGF分泌的多通道、时空分辨活细胞成像。该技术不仅能区分同源与异源受体复合物,还可同步解析多种抑制剂的作用靶点与动态效应,为复杂信号网络研究和靶向药物开发提供了强大工具。成果已发表于ACS Nano,具有广泛的应用前景。
— 内容由好学术AI分析文章内容生成,仅供参考。
肝细胞生长因子/c-间充质-上皮转化因子(HGF/c-Met)信号通路的失调刺激侵袭性上皮间充质转化,并通过刺激血管内皮生长因子(VEGF)的分泌建立致病性反馈回路。目前上述受体二聚化检测方法在区分寡聚状态并将其与下游活性相关联方面存在局限性。针对这一问题,西安交通大学药学院王嗣岑、解笑瑜教授团队构建了一种催化DNA电路驱动的表面增强拉曼散射放大检测平台(CDCSA),实现了对药物-受体信号通路激活与反馈调节进行时空分辨的多路复用检测,并成功用于三种针对该通路不同节点抑制剂的药物靶点剖析。
在本研究中,利用靶标触发的催化发夹组件引导不同的报告探针和增强探针形成多种等离子体网络,产生放大的多通道SERS输出。研究结果表明,该策略能够独立和同时检测c-Met同源二聚体和相应的VEGF分泌,同时区分c-Met/c-Met同源二聚体和c-Met/VEGFR异二聚体。通过对三种机制不同的抑制剂进行检测,验证了CDCSA平台用于药物-受体相互作用时间分辨监测中的优异性能。这一创新技术可以广泛适用于各种细胞膜生物标志物,为分析复杂的信号网络和加速靶向药物发现提供了一种通用的方法。
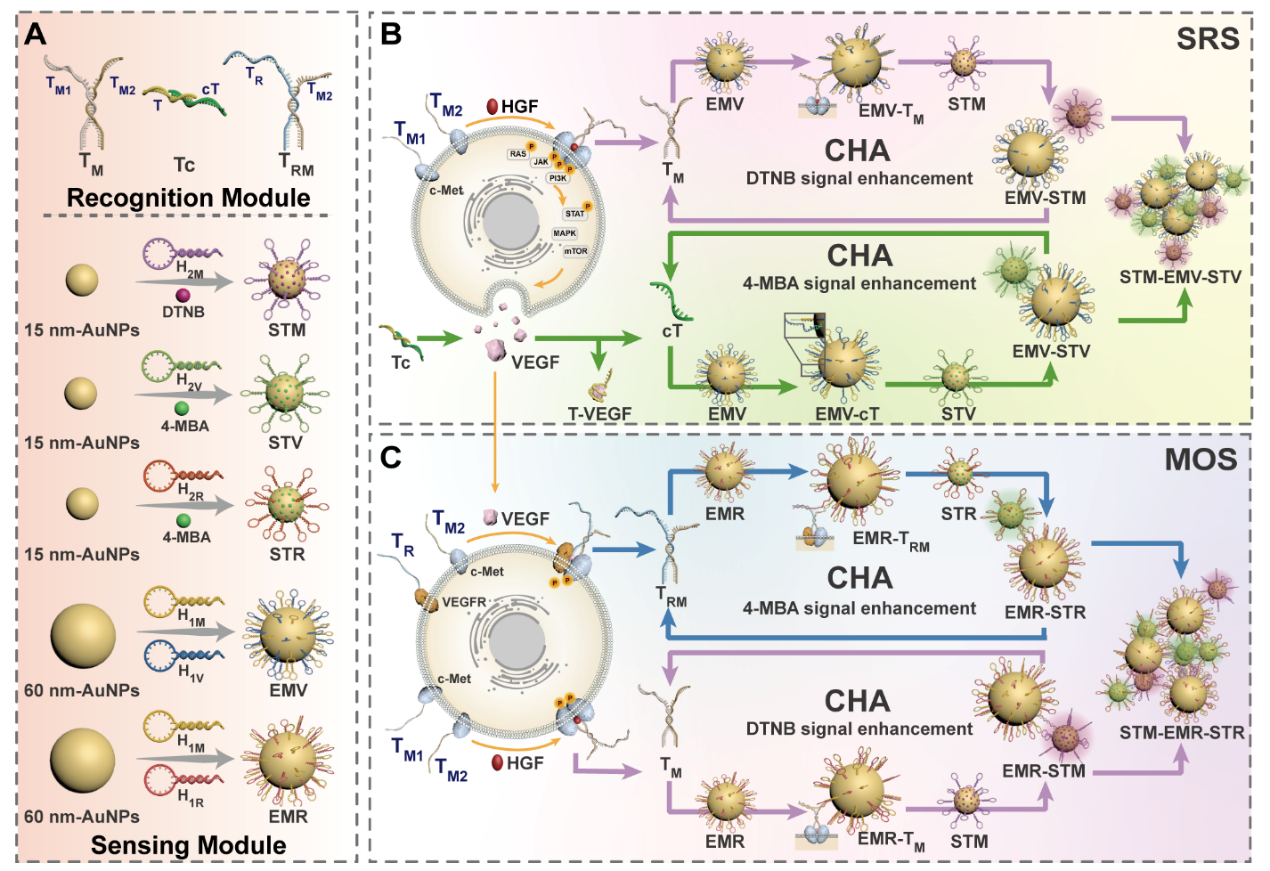
CDCSA平台的构建与应用
相关研究以《催化DNA电路驱动的表面增强拉曼散射放大技术实现受体串扰和反馈调节的多重活细胞成像》(Catalytic DNA Circuit-Driven Surface-Enhanced Raman Scattering Amplification Enables Multiplexed Live-Cell Imaging of Receptor Crosstalk and Feedback Regulation)为题发表在国际纳米材料领域权威期刊《美国化学会纳米杂志》(ACS Nano)上。西安交通大学药学院博士研究生王赵嘉为论文第一作者,王嗣岑教授、解笑瑜教授和胡琪副教授为共同通讯作者,西安交通大学为唯一通讯单位。
研究工作得到了国家自然科学基金、陕西省重点研发项目、西安市科协青年人才支持计划、西安交大青年拔尖人才计划的共同资助,实验测试得到西安交大分析测试中心的大力支持。
论文链接:https://pubs.acs.org/doi/10.1021/acsnano.5c18629
王嗣岑教授主页链接:http://gr.xjtu.edu.cn/en/web/wangsc
解笑瑜教授主页链接:https://gr.xjtu.edu.cn/en/web/xiexy
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。



















我还在想SERS怎么复用成像,看到DNA电路那块突然就懂了,设计挺巧的
c-Met这靶点一直难搞,他们这平台要是真稳定,以后筛药省事多了
同源二聚体和异二聚体都能分清?有点东西👍
前几天组会刚讲到信号通路检测,这方法说不定能解决我们实验室的痛点
这技术听着挺玄乎,真能用在新药研发上吗?