研究揭示TBPH经肠道菌群—花生四烯酸代谢轴促炎症性肠病发生机制
文章导读
你是否想过,日常生活中无处不在的阻燃剂,竟可能悄悄破坏你的肠道健康?最新研究发现,新型溴代阻燃剂TBPH会扰乱肠道菌群,导致有益菌阿克曼氏菌(AKK)减少,进而引发花生四烯酸(AA)代谢失衡,激活“PLA2–COX2–PGE2–NF-κB”炎症轴,持续放大肠道炎症,诱发炎症性肠病(IBD)。更关键的是,补充AKK菌可有效逆转这一损伤,修复肠道屏障。这项由中国科学院水生生物研究所完成的研究,首次揭示了环境污染物通过“菌群—代谢轴”致病的深层机制,为IBD的环境病因提供了全新解释,也为预防和干预策略带来重要启示。
— 内容由好学术AI分析文章内容生成,仅供参考。
炎症性肠病(IBD)的全球发病率持续上升,环境污染物暴露是其重要的诱发因素。新型溴代阻燃剂TBPH在环境与人体样本中广泛检出,但其对肠道健康的影响机制尚不明确。近日,中国科学院水生生物研究所团队,阐明了TBPH如何通过扰乱“肠道菌群—花生四烯酸(AA)代谢轴”,促进IBD发生,并证实补充阿克曼氏菌(AKK)可有效缓解损伤。
研究发现,TBPH暴露会导致小鼠结肠缩短、杯状细胞减少、黏液层变薄,并伴随血清促炎因子(TNF-α、IL-1β、IL-6)水平升高,呈现典型的肠道屏障损伤与系统性炎症表型。深入机制研究表明,TBPH会减少肠道中的关键保护菌——AKK的丰度,进而引起AA代谢紊乱,导致AA在体内异常累积。AA进一步激活下游的PLA2–COX2–PGE2–NF-κB信号通路,持续放大炎症反应,破坏肠道紧密连接蛋白表达,最终导致肠道屏障功能损伤,引起IBD样病理。
靶向检测进一步证实,TBPH暴露会明显升高结肠组织中AA、PGE2及PLA2水平,并上调COX2、Ptges、EP2等AA代谢通路关键蛋白表达,同时增强NF-κB信号通路活化,这表明TBPH通过PLA2–COX2–PGE2–NF‑κB信号通路加剧了肠道炎症损伤。补充活体AKK可有效降低AA蓄积、抑制该炎症级联反应,并促进黏液屏障与紧密连接蛋白的修复,从而缓解肠道病理损伤。这证实了AKK对污染物诱导的肠损伤具有关键保护作用,这一作用通过调节AA代谢与炎症反应实现。
该研究有助于学界进一步了解TBPH的肠道毒性及其潜在机制,对环境污染物健康风险评估及基于微生物的防治策略具有重要参考价值。
相关研究成果发表在《环境科学与技术》(Environmental Science & Technology)上。研究工作得到国家重点研发计划和国家自然科学基金的支持。
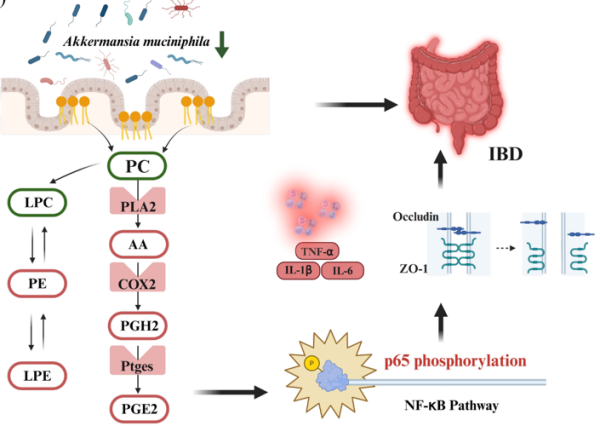
TBPH通过激活AA代谢通路与NF-κB信号加剧肠道炎症
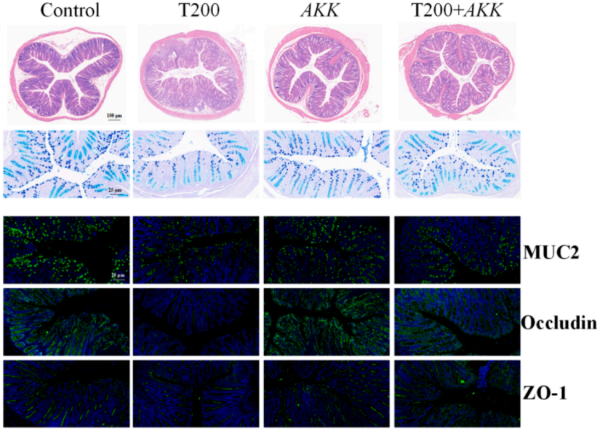
补充AKK缓解TBPH诱导的AA代谢紊乱
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。


















感觉还行,就是这类研究最后都卡在临床应用上,难落地。
有人试过自己补AKK吗?网上卖的那些“含AKK”的益生菌靠谱不?
这通路激活也太狠了,AA一堆积就发炎,人体真是精密又脆弱hhh
说白了就是菌群一乱,代谢跟着崩,肠子就扛不住了,道理挺通顺。
TBPH到底啥时候能禁啊,一边检出一边还让人补菌,治标不治本吧?
前几天刚查出肠炎,吓得我都不敢乱吃东西了,这研究来得及时 👍
PLA2–COX2–PGE2–NF-κB这一串通路真不是闹着玩的,炎症一启动就停不下来了…
补充AKK就能缓解?那市面上那些益生菌有没有用啊?
这玩意儿听着就挺吓人,现在环境污染物这么多,肠子还能好得了吗?