东南大学朱新建课题组在《Advanced Science》发表最新研究成果
文章导读
癫痫发作后,大脑为何会陷入“屏障破损-炎症加重”的恶性循环?长期以来,其核心启动机制一直是个谜。东南大学的最新研究首次揭示:一种名为CircPTPN4的环状RNA,正是撬开大脑“防护大门”——血脑屏障的关键“开关”。它不仅描绘了从分子到病理的完整作用通路,更意味着未来或可通过检测血浆中的它来预警病情,甚至开发出阻止神经损伤加剧的全新疗法。
— 内容由好学术AI分析文章内容生成,仅供参考。
(通讯员 杨久荣)近日,东南大学朱新建课题组在国际权威学术期刊《Advanced Science》上在线发表了题为《环状RNA CircPTPN4在癫痫发生早期促进血脑屏障破坏》(Circular RNA PTPN4 Contributes to Blood-Brain Barrier Disruption during Early Epileptogenesis)的研究论文,该研究首次系统阐明了一种名为CircPTPN4的环状核糖核酸(Circular RNA)在癫痫发生早期破坏血脑屏障(Blood-Brain Barrier, BBB)完整性的全新分子机制,为癫痫相关神经损伤的诊断与干预提供了极具潜力的新靶点与生物标志物。
血脑屏障是守护中枢神经系统内部环境稳定的关键结构,其功能完整对于维持脑健康至关重要。癫痫发作后,血脑屏障的完整性常遭到破坏,这被视为加剧病情恶性循环的关键环节——屏障的破损使得外周有害物质及炎症细胞易于侵入脑实质,从而诱发更为严重的神经炎症反应进一步降低癫痫发作阈值,导致发作更频繁、损伤更重。然而,癫痫病理状态究竟如何“撬开”这扇关键的防护大门,其核心启动机制长期以来并未明晰,这也成为临床预防相关继发性神经损伤的主要瓶颈。
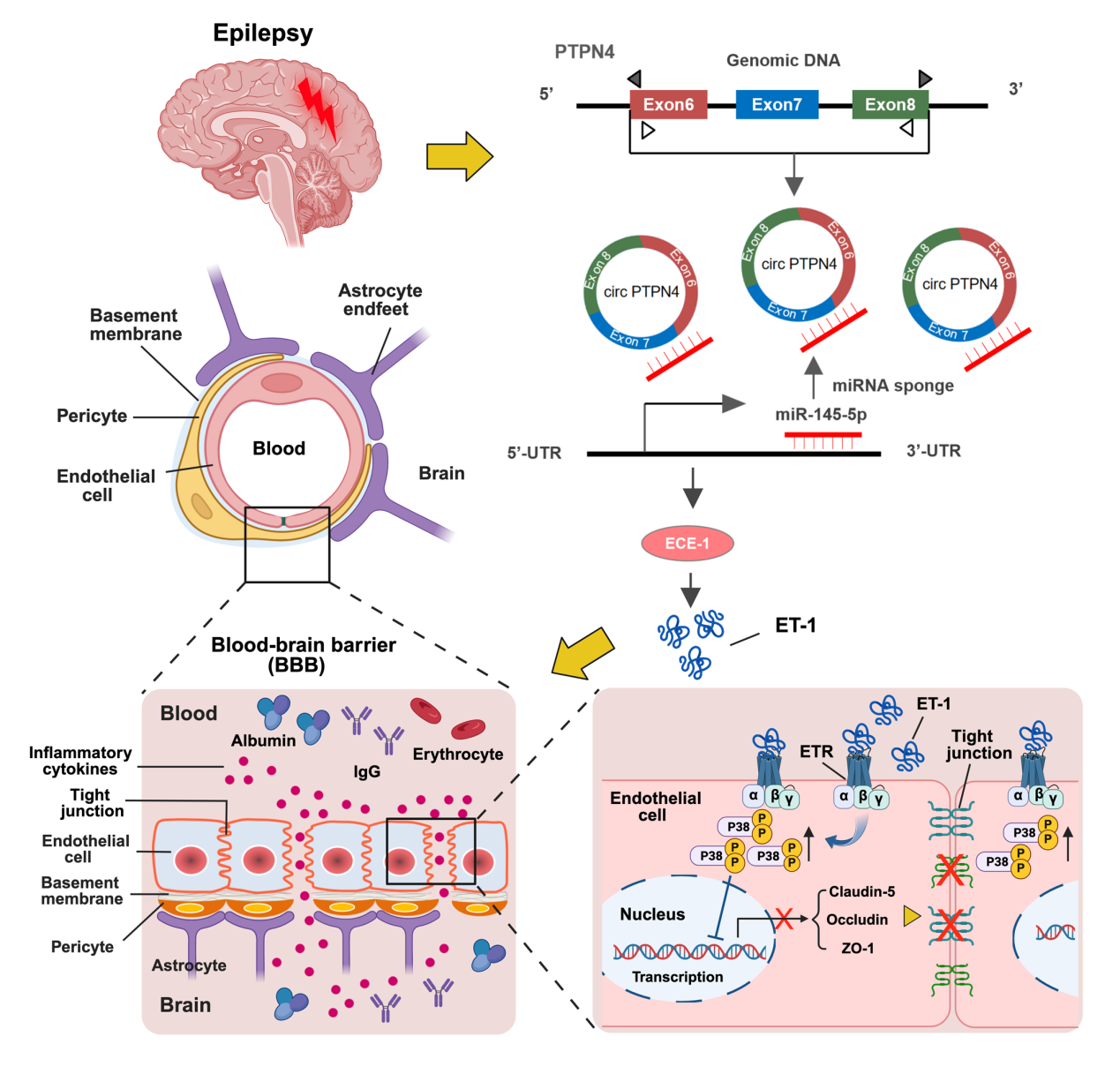
该研究正是针对这一核心问题取得了突破。研究团队通过高通量环状RNA测序技术发现,在癫痫模型小鼠的脑皮层组织中,CircPTPN4的表达水平异常显著升高。随后的细胞与在体实验均证实,该分子在癫痫病理环境下的脑微血管内皮细胞中特异性上调,扮演着“破坏BBB开关”的角色。功能实验表明,过表达CircPTPN4会直接导致脑内皮细胞通透性增加,破坏血脑屏障功能;反之,利用技术手段敲低其表达,则能有效减轻屏障损伤,并显著降低慢性期小鼠的自发性癫痫发作频率。
在机制层面,研究团队描绘出了一条清晰而完整的分子作用通路:CircPTPN4在细胞内作为“分子海绵”,竞争性吸附并抑制了具有保护作用的微小RNA—miR-145a-5p。这种吸附作用导致miR-145a-5p的靶基因之一,内皮素转化酶1(ECE-1)的表达水平上升。升高的ECE-1会催化产生更多具有强烈缩血管及促炎作用的内皮素-1(ET-1)。ET-1进而激活内皮细胞内的p38丝裂原活化蛋白激酶(p38/MAPK)信号通路,最终导致决定细胞间连接紧密程度的“铆钉”—紧密连接蛋白(如ZO-1, Occludin等)的表达下调。这条从CircPTPN4到p38/MAPK的级联反应,构成了癫痫早期血脑屏障通透性增加的核心机制。
研究发现,癫痫小鼠血浆中的CircPTPN4含量与血脑屏障的损伤严重程度呈正相关,并证实其来源于脑内的内皮细胞。这一发现意味着血浆中的CircPTPN4有望被开发为一种便捷、无创的液体活检标志物,用于早期预警和动态监测癫痫患者的血脑屏障状态。在治疗上,该研究明确了CircPTPN4/miR-145a-5p/ECE-1轴是一个全新的干预靶点。未来,通过设计特异性抑制CircPTPN4的药物或基因治疗手段,有望从源头上阻止癫痫引发的血脑屏障破坏,从而切断神经损伤加剧的病理链条,为开发癫痫的神经保护性疗法开辟崭新方向。
该论文第一作者为东南大学博士生杨久荣,朱新建副教授为唯一通讯作者,东南大学为第一通讯单位。该研究得到国家自然科学基金面上项目、江苏省自然科学基金、中央高校基本科研业务费专项资金等项目资助。
原文链接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202502250
供稿:医学院
(责任编辑:周子琪 审核:宋业春)
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。


















哈哈,名字看着绕口但作用挺直接,科研加油,赵教授别忘了多发几篇科普文章让大家能看懂😊
如果能针对CircPTPN4做基因干预,或许能大幅减少继发神经损伤,作者要不要考虑联合抗炎或血管保护策略验证疗效?
实验设计很严谨,但我想知道这种CircPTPN4在人类癫痫患者样本里的表达一致性如何,动物到人能否直接对应?
这项工作太有潜力了,血浆标志物如果能临床转化,监测会方便很多,期待后续药物开发。