文章导读
肿瘤免疫疗法遭遇瓶颈?STING靶点新药临床试验屡屡受挫,其背后原因是什么?清华大学团队的最新发现可能揭开了关键谜底。他们不仅鉴定出一种能强力激活免疫、兼具抗病毒与抗肿瘤潜力的新型分子GNE-6468,更借助冷冻电镜首次窥见其作用的全新机制:它竟靶向一个前所未有的“隐秘口袋”,并协同一种名为PI4P的脂质分子,像“分子钥匙”与“分子胶”般共同撬动STING蛋白,开启免疫应答。这项发表于顶级期刊《免疫》的研究,为设计下一代高效、精准的免疫疗法提供了颠覆性的新思路。
— 内容由好学术AI分析文章内容生成,仅供参考。
近年来,干扰素基因刺激因子(STING)作为肿瘤免疫治疗的研究热点,其激动剂的开发在基础研究中进展显著。然而,多项STING激动剂的临床试验尚未达到预期疗效,提示未来需开展更深入的机制研究、药物优化及联合用药探索。
近日,清华大学药学院张从刚研究员课题组、刘翔宇研究员课题组与陆军军医大学陆军特色医学中心陈客宏主任医师团队合作研究鉴定出一种新型STING激动剂GNE-6468,该分子可高效激活STING介导的天然免疫应答与非经典自噬,在细胞及动物模型中展现出潜在的抗病毒与抗肿瘤免疫治疗价值。机制研究表明,GNE-6468靶向STING跨膜区的一个全新结合口袋,并与位于STING二聚体之间的PI4P相互协同,共同诱导STING跨膜区构象变化,进而促进其多聚化及下游信号激活。
研究团队依托清华大学药学院药物技术中心平台,建立基于细胞的免疫功能筛选体系,系统筛选天然免疫激动剂。通过高通量小分子化合物筛选,鉴定出GNE-6468能在多种细胞及人源化小鼠中强烈诱导I型干扰素反应,显著激活天然免疫应答。进一步研究表明,GNE-6468可强烈激活TBK1-STING-IRF3信号通路的磷酸化,且该免疫激活效应依赖于STING和TBK1,而不依赖于cGAS,提示GNE-6468很可能是一种新型STING激动剂。
为深入阐明其作用机制,研究团队利用冷冻电镜技术成功解析了人源STING与GNE-6468复合物的高分辨率结构。结构显示,GNE-6468结合于由STING的TM2、TM3和TM4所形成的跨膜区口袋中,这是一个此前未曾被定义的崭新激动剂结合位点。GNE-6468的结合促使STING的TM3螺旋发生大幅位移,从而诱导STING多聚化与激活。令人意外的是,结构中还观察到位于STING二聚体之间的PI4P分子(经质谱鉴定确认),其发挥类似“分子胶”的作用,与GNE-6468协同激活STING天然免疫信号。基于该独特机制以及GNE-6468在TM2-TM3区域的特殊定位,研究发现STING抑制剂H-151(作用于TM2-TM3 loop)和PI4KB抑制剂(抑制PI4P生成)均能在极低浓度下有效抑制GNE-6468介导的免疫反应。这些结果从分子层面揭示了GNE-6468与PI4P协同激活STING的机制,深化了科学界对PI4P免疫调控功能及STING激活机理的认识。
在机制研究基础上,研究团队进一步对GNE-6468的生物学功能进行了系统表征。研究发现,GNE-6468不仅能激活I型干扰素天然免疫反应,还可诱导非经典自噬,这一特性与其他靶向跨膜区的STING激动剂(如C53)明显不同。同时,研究在多种人源样本中验证了GNE-6468激活免疫反应的能力。为评估其在抗病毒与抗肿瘤免疫治疗中的潜力,团队开展了系统的功能实验,结果显示GNE-6468能以STING依赖的方式发挥强烈的抗病毒与抗肿瘤免疫效应;此外,GNE-6468与PD-1抗体联合用药也表现出显著的协同抗肿瘤效果。
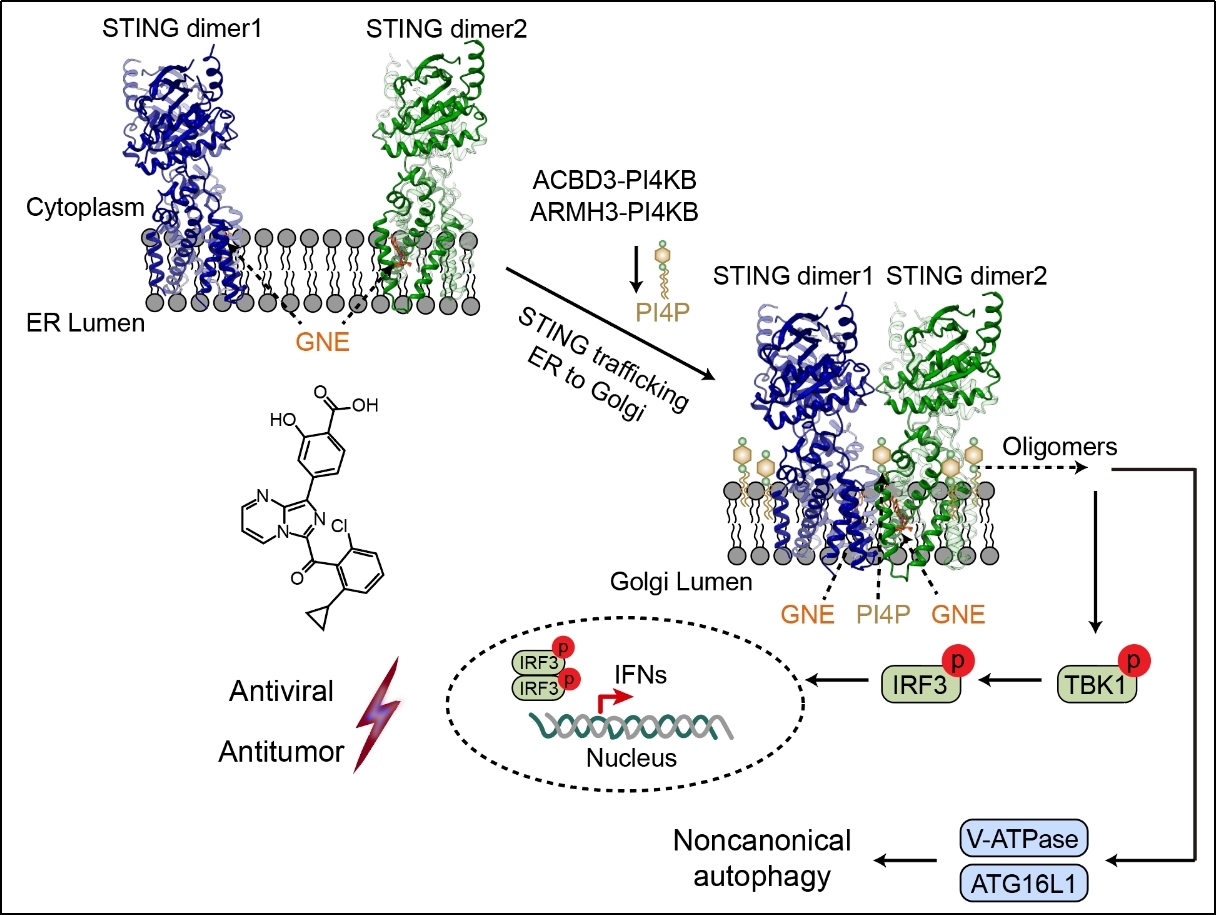
STING新型激动剂与高尔基体PI4P诱导跨膜区变构激活天然免疫
综上所述,该研究阐明GNE-6468是一种靶向全新跨膜区作用位点的新型高效STING激动剂,在抗感染与抗肿瘤治疗中具备潜在临床应用价值。
研究成果以“STING新型激动剂与高尔基体PI4P诱导跨膜区变构激活天然免疫”(A chemical agonist and the Golgi-resident lipid PI4P activate STING by inducing transmembrane helix rearrangement)为题,以研究论文形式于12月5日发表于《免疫》(Immunity)。
张从刚、刘翔宇和陈客宏为论文通讯作者,清华大学药学院博士后韩晶(已出站)、药学院2025届博士毕业生张书豪、2022级博士生侯燕飞和汪依为论文第一作者。
研究得到北京市自然科学基金、国家自然科学基金项目、膜生物学国家重点实验室、清华-北大生命科学联合中心、北京生物结构前沿研究中心、山西医科大学-清华大学前沿医学协同创新中心、清华大学自主科研笃实专项等的资助支持。
论文链接:
https://www.cell.com/immunity/abstract/S1074-7613(25)00506-0
供稿:药学院
编辑:李华山
审核:郭玲
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。


















希望能看到更多关于这个激动剂副作用的研究
PI4P居然能协同激活STING,这个机制突破值得关注
研究团队强强联合,清华的科研实力果然顶尖
这个发现太厉害了!期待早日临床应用👍