中国海洋大学在微生物天然产物“酶—非酶”协同催化领域取得新进展
文章导读
你知道pH值能像隐形开关一样,操控微生物制造抗癌药物吗?中国海洋大学团队在《Science Advances》发表突破性研究,首次破解烟曲霉中"酶-非酶"协同催化的神秘机制。当环境在酸碱间切换,同一个基因簇竟能分别合成两种抗癌活性分子——既能形成螺环结构,又能生成开环β-咔啉。更令人振奋的是,新发现的化合物在斑马鱼实验中表现出显著抑制血管生成的效果,且无细胞毒性,有望开创非细胞毒抗肿瘤药物研发新路径。这项发现不仅改写了天然药物合成规则,更为药物研发打开了全新思路。
— 内容由好学术AI分析文章内容生成,仅供参考。
近日,中国海洋大学医药学院、青岛海洋科技中心海洋药物与生物制品实验室、海洋药物教育部重点实验室王乂和朱伟明教授团队,在国际知名学术期刊Science Advances在线发表题为“A unique mechanism involving cocatalysis of enzyme and nonenzyme to form β-carboline and spirotryprostatins in Aspergillus fumigatus”(烟曲霉中一种酶–非酶协同催化形成β-carboline和spirotryprostatins类化合物的独特机制)的研究文章。该研究首次揭示了pH胁迫下真菌吲哚生物碱骨架“酶—非酶”协同催化新机制,为天然产物高效发现与药物先导化合物的挖掘提供了新思路。
天然产物一直以来都是药物的重要来源,吲哚生物碱因其多样的结构和广泛的生物活性(如抗菌、抗肿瘤、抗病毒等)而备受关注。其中,β-carboline(βCs)和spirotryprostatins(STs)两类天然吲哚分子的生物合成途径研究相对较少。βCs只有3种Pictet–Spengler骨架形成酶有报道,同时STs仅知FqzB/FtmG与螺环形成有关且部分假说缺乏实验佐证,而且pH等环境因子如何驱动其结构多样性亦未阐明。
研究团队以海洋红树林来源耐酸曲霉为研究对象,模拟天然酸胁迫环境进行发酵,通过系统的代谢产物分离纯化、波谱学结构解析与量子化学计算,捕捉并鉴定得到一类结构罕见的开环β-咔啉化合物SFs。进一步调节pH至中性,发现了含有双键的关键中间体Db-FTs。酸—碱“两副面孔”让研究人员意识到,pH是调控骨架走向的“隐形开关”。基因组分析揭示这些化合物的合成受一段含有P450酶编码基因ftmG的生物合成基因簇调控。为探明其生物合成机制,研究团队通过基因敲除与异源表达实验,明确了FtmG是途径中的关键催化酶。FtmG能将饱和型底物Sb-FTs氧化生成双键中间体Db-FTs及双羟基中间体Dh-FTs,但并不直接催化生成STs或SFs。随后,研究人员在体外重构体系中发现,这些氧化中间体在不同pH条件下可自发产生截然不同的化学转化。在中性环境中,经氧气参与的分子内环化反应生成螺环产物STs;而在酸性条件下,则经酰胺键断裂与分子重排生成开环型β-咔啉衍生物SFs。进一步的同位素示踪和酶催化对照实验表明,这些关键转化步骤并非由酶直接催化,而是由FtmG生成的高能中间体在特定环境条件下自发完成的非酶促反应,体现出“酶促氧化激活+环境条件诱导重排”的协同机制。研究还通过分子对接与定点突变鉴定出FtmG活性位点中的关键残基 Arg292与Cys442,在控制底物定位及选择性氧化中发挥核心作用。基于此机制,研究人员进一步在体外条件下调控pH与氧环境,实现了多种FtmG产物的可控转化,成功复现了体内生成STs与SFs的过程(图1)。
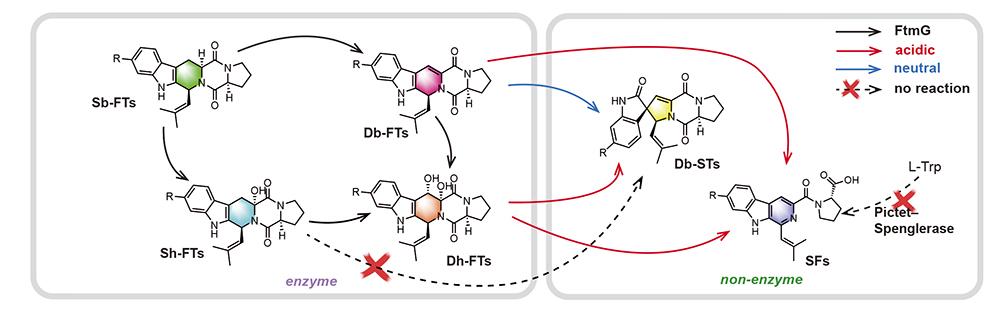
图1 本研究涉及的生物合成途径总结示意图
研究发现,新型SFs类化合物在斑马鱼胚胎模型中能够明显抑制新生血管的形成,同时对红细胞生成过程具有显著的抑制作用,且在多种哺乳动物细胞系中均未表现出明显的细胞毒性,提示该类化合物的作用机制可能区别于传统的细胞毒性抗肿瘤药物,具有开发为新型非细胞毒抗肿瘤药物先导分子的潜在应用价值。本研究不仅拓宽了P450酶的催化版图,也首次用实验证据系统阐明了pH驱动天然产物骨架多样性的机制,为海洋乃至陆地微生物来源的天然药物发现和生物合成途径重构提供了重要启示。

图2 研究团队合影(第三排中间为王乂教授,第三排左起第四位为朱伟明教授)
中国海洋大学为该研究的第一完成单位和唯一通讯单位,中国海洋大学毕业博士生高海与博士研究生于登为共同第一作者,王乂教授和朱伟明教授为共同通讯作者,研究得到了国家自然科学基金等项目资助。
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...