文章导读
癌症免疫治疗迎来重大突破!你是否想过,mRNA疗法能像精准导弹般只攻击肿瘤而不伤及肝脏?上海交大联合团队在《ACS Nano》发表的这项研究,正让这一愿景成为现实。他们首创的"花型"脂质纳米颗粒,通过精妙调控胆固醇结构,成功骗过体内载脂蛋白E的识别机制,使mRNA药物在肿瘤局部高效释放的同时,几乎完全避开了肝脏摄取。这意味着困扰学界许久的细胞因子毒性难题被巧妙化解,治疗安全性实现质的飞跃。更令人振奋的是,该技术已在乳腺癌模型中证实可激活强大免疫应答,甚至能与术后防复发方案完美结合。这项研究不仅为癌症患者带来新希望,更开创了mRNA递送系统设计的新范式。
— 内容由好学术AI分析文章内容生成,仅供参考。
近期,上海交通大学药学院郭圣荣团队联合生物医学工程学院王飞虎团队,在 ACS Nano上发表题为“Flower-shaped lipid nanoparticles evade apolipoprotein E–mediated liver tropism for safe and enhanced cytokine-based cancer immunotherapy” 的研究论文。该研究首次通过胆固醇结构精细调控构建出一种“花型状”脂质纳米颗粒(RLNP),在保证mRNA局部高效递送的同时,显著减少血清载脂蛋白E(ApoE)的吸附,从而避免肝脏摄取和细胞因子相关毒性。该策略为实现安全,可控的mRNA肿瘤免疫治疗提供了新的设计思路。

脂质纳米颗粒(LNP)作为mRNA递送的核心载体,已在疫苗与基因治疗中获得广泛应用。然而,即使局部注射入瘤内,部分LNP仍会经血液循环进入肝脏,与血浆中的ApoE结合后被LDL受体介导摄取,引发异位细胞因子表达与肝毒性反应。
为突破该问题,郭圣荣团队联合王飞虎团队提出以胆固醇结构为中心的形貌调控策略,通过在胆固醇3β位羟基处引入TLR7/8激动剂雷西莫特(Resiquimod),合成免疫活性衍生物R-Chol,从而在LNP自组装过程中诱导形成花型结构(RLNP),实现对ApoE吸附的抑制。研究表明,约50%胆固醇被R-Chol取代时,LNP自组装形成具有规则表面突起的花瓣状结构(花型RLNP)。Cryo-TEM和SAXS分析揭示该结构表面曲率显著增大,使得ApoE更难稳定吸附。体内实验结果显示,RLNP在瘤内注射后几乎完全避免肝脏富集,同时维持高效的局部mRNA表达,并显著降低IL-12 mRNA治疗导致的肝细胞凋亡与炎症反应。相比传统LNP,RLNP组小鼠血清ALT/AST水平接近基线,展现出优异的生物安全性。此外,团队还通过流体力学模拟进一步揭示机制:花瓣状RLNP表面局部剪切力较球形LNP提升约2.25倍,可增强蛋白脱附并抑制ApoE结合。该结构的流体–蛋白相互作用模型首次从物理层面解释了LNP形貌与蛋白冠形成之间的量效关系。
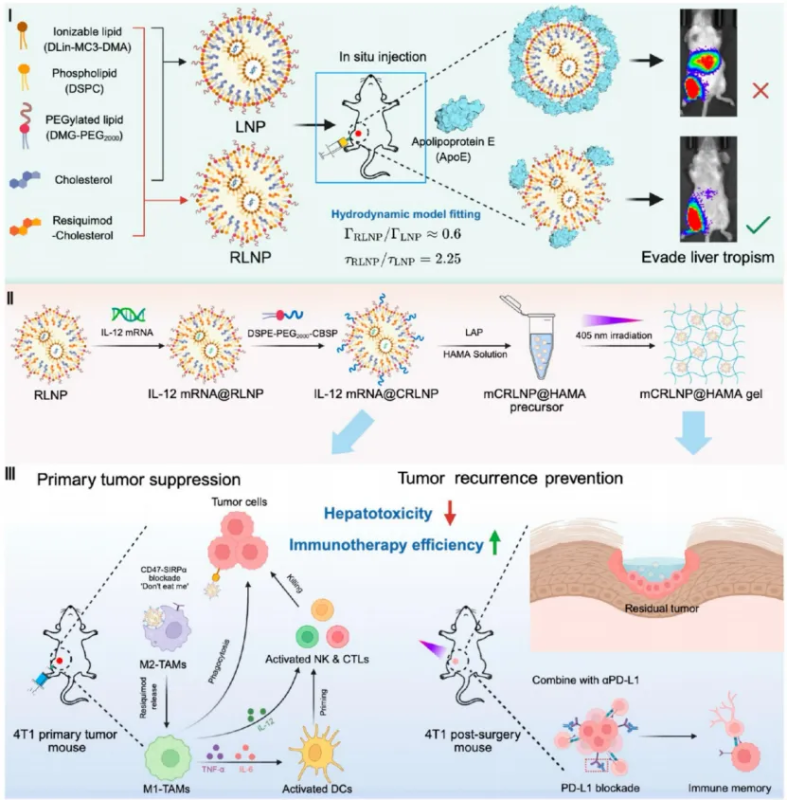
Scheme 1. (I) Schematic illustrations showing the composition of flower-shaped lipid nanoparticles (RLNPs). (II) Design, preparation, and functional modifications of RLNP-based formulations. (III) RLNP-based formulations enable effective cytokine mediated cancer immunotherapy, including intratumoral delivery of IL-12 mRNA@CRLNP to orchestrate macrophage-mediated immune cascades against primary tumors, and postoperative cavity filling with mCRLNP@HAMA gel in combination with αPD-L1 therapy to prevent tumor recurrence.
在花型RLNP基础上,研究团队进一步在其表面修饰CD47-SIRPα阻断肽(CSBP),并负载IL-12 mRNA(IL-12 mRNA@CRLNP)。在原位4T1乳腺癌模型中,IL-12 mRNA@CRLNP组显著抑制肿瘤生长,促进CD8⁺ T细胞、NK细胞浸润,复极化M2巨噬细胞并激活IFN-γ与TNF-α等细胞因子通路,展现出强效抗肿瘤免疫。此外,研究团队将IL-12 mRNA@CRLNP嵌入光交联透明质酸甲基丙烯酰(HAMA)水凝胶中,构建mCRLNP@HAMA复合体系。该体系可在肿瘤切除空腔原位成胶,持续释放IL-12 mRNA并与αPD-L1联用,实现术后免疫微环境重塑与记忆T细胞形成。
综上所述,该研究提出了以胆固醇结构调控LNP形貌与蛋白冠形成为核心的设计理念,突破了传统mRNA递送体系中ApoE介导的肝脏富集难题,不仅深化了对mRNA-LNP结构–性能关系的理解,也为细胞因子类mRNA免疫治疗的临床转化提供新见解。
上海交通大学药学院郭圣荣和生物医学工程学院王飞虎为该论文的共同通讯作者。上海交通大学药学院博士研究生祁一鸣和硕士研究生傅玉立为共同第一作者。
论文链接:https://pubs.acs.org/doi/10.1021/acsnano.5c11552
作者: 郭圣荣 供稿单位: 药学院
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...