电子科技大学医学院张坤教授团队在Advanced Materials发表最新研究成果
文章导读
肿瘤为何能逃避免疫系统追杀?关键竟藏在“酸性微环境”与乳酸的共谋之中。张坤教授团队在《Advanced Materials》发表突破性成果,创新设计一种多通道免疫纳米调节器AL@O₂-FMRC,首次实现同步逆转酸性环境、阻断乳酸代谢与重编程巨噬细胞。超声触发下,它不仅能切断免疫抑制源头,还能激活多重抗肿瘤免疫反应,在多种模型中显著抑制肿瘤生长、延长生存期。这一“源头治理”新策略,有望为免疫治疗耐受难题提供全新解决方案。
— 内容由好学术AI分析文章内容生成,仅供参考。
近日,医学院张坤教授团队在国际材料学顶级期刊《Advanced Materials》(IF=26.8)上发表了题为《Multichannel Immune Nanoregulators Suppress Lactic Acid Metabolism and Lactic Acid-Shaped Acidic Microenvironment to Uproot Anti-Tumor Immunosuppression》的研究论文。张坤教授实验室2025级博士研究生彭秋霞为论文共同第一作者,张坤教授、蔡璐璐教授为共同通讯作者。
该研究创新性地构建了一种多通道免疫纳米调节器,通过同时逆转肿瘤酸性微环境、抑制乳酸代谢与重编程肿瘤相关巨噬细胞,从根源上切断了肿瘤免疫抑制的关键通路,为免疫治疗耐受的肿瘤提供了全新的治疗策略。

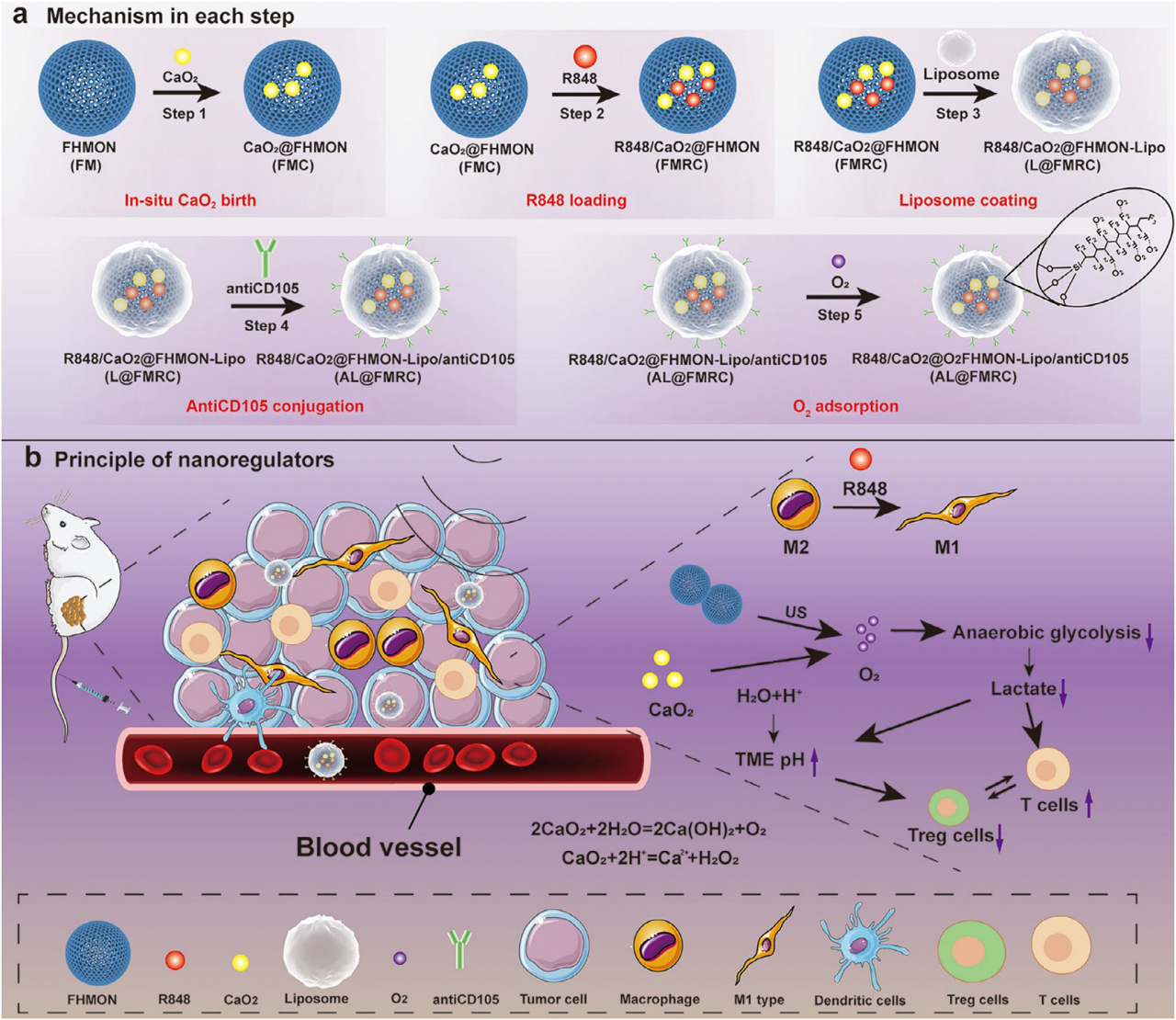
多通道免疫纳米调节器的构建及其作用机制示意图
肿瘤微环境中的乳酸及其塑造的酸性条件是导致免疫抑制的核心因素之一。传统免疫治疗策略多聚焦于巨噬细胞表型转换,却难以阻断乳酸持续产生所驱动的免疫抑制源头。张坤教授团队设计的多通道免疫纳米调节器(AL@O₂-FMRC),以氟碳链修饰的中空介孔有机硅为载体,原位合成CaO₂并负载免疫激动剂R848,进一步通过脂质体包覆、CD105抗体修饰及氧吸附,构建了具有多重响应与靶向功能的纳米系统。该纳米系统在超声触发下可释放大量氧气,消耗H⁺并抑制糖酵解途径的乳酸生成,从而在缓解肿瘤缺氧与酸性的同时,切断了乳酸驱动的巨噬细胞M2极化源头。此外,R848的释放进一步促进M2向M1表型转化,协同Ca²⁺与H₂O₂诱导的肿瘤钙化与凋亡,实现了对肿瘤免疫微环境的系统性重塑。在多种体内外模型中,该纳米系统均表现出优异的抗肿瘤效果:显著提升CD8⁺ T细胞、NK细胞与M1型巨噬细胞浸润,抑制Treg与MDSCs等免疫抑制细胞,最终实现肿瘤生长有效抑制与生存期显著延长。
张坤教授团队长期从事超声诊疗、介入热消融、肿瘤、免疫、纳米医学、再生医学、神经调控等生物医学工程与多学科交叉方向研究,近年来以第一或通讯在Cell、Nat Commun、Adv Mater 等杂志发表SCI论文90余篇。
论文链接:https://doi.org/10.1002/adma.202512230
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...