电子科技大学医学院科研团队在Molecular Therapy、Molecular Psychiatry和elife发表3篇论文
近日,电子科技大学医学院衰老研究团队在Molecular Therapy、Molecular Psychiatry和elife发表论文,介绍了其在脑衰老机制研究、神经退行性疾病的炎症调控机制研究和酵母衰老机制研究方面的成果。
在脑衰老机制研究方面,团队在国际顶级期刊Molecular Therapy(中科院一区,IF=12)发表了题为“Complement C4b as a Key Mediator of Synaptic Loss and Cognitive Decline in Brain Aging”的论文。该研究首次揭示补体蛋白C4b是大脑衰老过程中突触丢失和认知功能下降的关键调控分子,为干预年龄相关性认知障碍提供了新的潜在靶点。论文共同第一作者为刘婷、罗路南、李飞扬、唐程,共同通讯作者为杨静教授、郑敏教授、郑毅副教授以及美国加州大学旧金山分校李浩教授。电子科技大学为该项研究的第一完成单位。

在全球老龄化不断加剧的背景下,解析大脑衰老的分子机制并开发有效干预策略已成为亟待解决的重大科学问题。本研究通过对大脑皮层和海马组织进行转录组分析,发现C4b在衰老过程中表达显著上调,并与神经炎症和突触退化密切相关。在细胞模型中,团队利用CRISPR-Cas13d基因编辑技术敲低C4b表达,成功恢复了衰老神经元的突触密度和钙信号活性。在动物实验中,通过AAV载体递送Cas13d/gRNA系统抑制老年小鼠脑内C4b表达,显著改善了其空间记忆和社会行为表现,并观察到突触结构的明显修复。该研究不仅系统阐释了C4b在脑衰老中的核心作用,也展现出RNA靶向基因治疗策略在延缓大脑功能衰退方面的广阔应用前景。
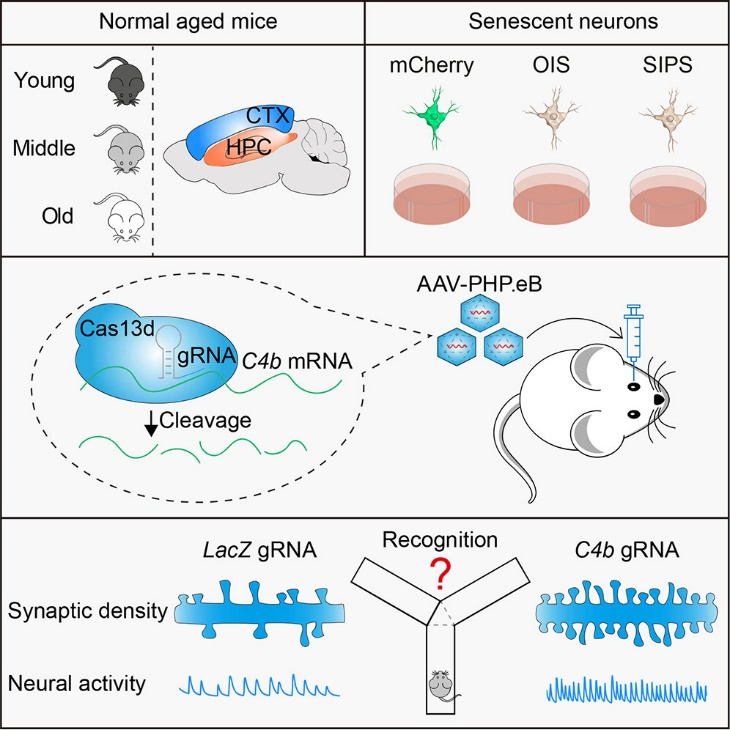
图1. 靶向抑制补体C4b可挽救老年小鼠的突触功能并重塑认知能力
在神经退行性疾病的炎症调控机制方面,团队在国际神经科学TOP期刊 Molecular Psychiatry (中科院一区,IF=10.1)发表了题为“Asrocytic Mettl14 depletion enhances cognitive function by attenuating astrogliosis via the DUSP1/MAPK pathway in APP/PS1 mice: targeting neuroinflammation in Alzheimer’s disease”的论文。电子科技大学为该项目的第一完成单位。杨露副教授、郑敏副教授及乐卫东教授为本文的共同通讯作者,滕燕副教授、博士研究生徐建丽及硕士研究生贺舒为本文的共同第一作者。
该研究以RNA表观修饰调控为切入点,通过构建甲基转移酶Mettl14条件性敲除的阿尔茨海默病经典模型小鼠,首次揭示了星形胶质细胞m6A修饰在AD神经炎症中的重要调控作用,为以表观遗传修饰的调控为手段调控神经炎症的AD疾病治疗策略提供了新的方向。

阿尔茨海默病(Alzheimer’s disease, AD)是老龄化社会中发病率最高的神经退行性疾病,其认知功能障碍的进展与神经炎症密切相关。近年来,以神经炎症为靶点的干预策略已成为AD治疗研究的重要方向。本研究以AD中神经胶质细胞RNA m6A甲基化修饰的异常为切入点,探讨通过基因干预调控星形胶质细胞m6A修饰对神经炎症的影响。研究团队利用CRISPR/Cas9技术构建了星形胶质细胞特异性Mettl14敲除的AD小鼠模型(AD-cKO),并结合原代神经细胞与基因敲除细胞系,在整体和细胞水平证实m6A修饰参与星形胶质细胞的活化并影响疾病的进程。实验结果显示,与对照组相比,AD-cKO小鼠的空间记忆能力显著改善,GFAP、C3等炎症标志物表达下降,提示星形胶质细胞活化受到抑制。进一步的MeRIP-seq与RNA-seq联合分析揭示,其作用机制涉及对DUSP1/MAPK信号通路的调控。本研究首次证实靶向星形胶质细胞m6A甲基转移酶METTL14可同时改善AD认知功能并缓解神经炎症,为AD的病理机制及治疗策略提供了新的理论依据。
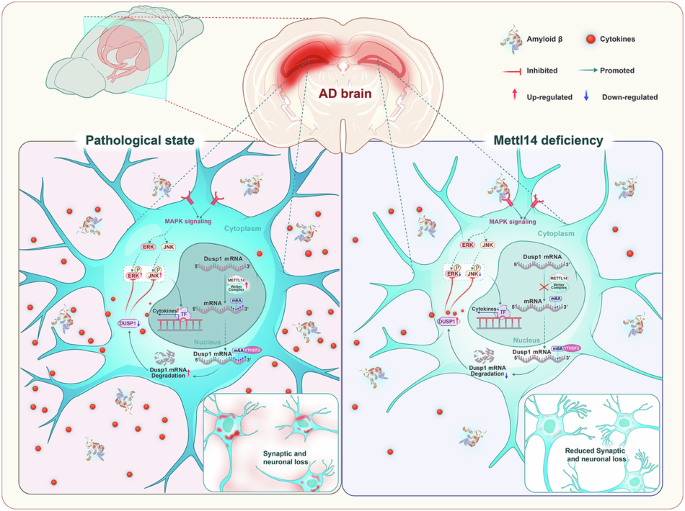
图2:全文图片摘要
在酵母衰老机制研究方面,团队国际顶级期刊eLife (中科院一区TOP期刊)发表了题为“Deletion of sulfate transporter SUL1 extends yeast replicative lifespan via reduced PKA signaling instead of decreased sulfate uptake”的论文。该项研究工作于2024年3月在eLife以Reviewed preprint形式预印,随后研究团队依据Reviewer和编辑的意见,补充完善了相关实验,并再次递送至eLife。经再次评审后,论文最终版本(Version of Record)于2025年9月3日在eLife正式发表。该研究首次揭示硫转运蛋白SUL1缺失可通过抑制PKA信号通路而非硫酸盐摄取途径,显著延长酵母复制性寿命。该研究为营养信号调控衰老的机制提供了新见解。论文第一作者为龙娟博士,任职于电子科技大学·四川省人民医院。共同通讯作者为电子科技大学医学院杨静教授、郑毅副教授,四川省人民医院龚波教授以及美国加州大学旧金山分校李浩教授。电子科技大学医学院研究生马猛和陈钰婷参与了该项工作。电子科技大学为该研究第一完成单位。

在营养感知与寿命调控的研究中,营养物质下游信号转导的作用日益受到关注。本研究以酿酒酵母为模型,系统探讨了硫转运蛋白SUL1在芽殖酵母复制性衰老调控中的功能及机制。通过基因缺失突变体构建及表型分析,发现SUL1缺失可显著延长酵母复制性寿命,且该效应不依赖于其硫酸盐转运功能。在机制层面,研究团队发现SUL1缺失突变体中PKA信号通路活性显著降低,通过调控转录因子MSN2核转位,上调应激反应基因的表达及自噬通路活化,最终导致应激保护性碳水化合物(海藻糖和糖原)积累及自噬活性增强,从而延长寿命。而酵母中另一参与硫转运的基因SUL2的缺失并不导致长寿表型出现,提示SUL1在酵母寿命调控中具有独特的功能。
该研究不仅发现了SUL1这一新型营养相关的寿命调控基因,同时对其调控机制进行了深入解析。研究表明,不同于常规的氨基酸、糖类和脂类物质对寿命的调控,以SUL1为代表的无机离子营养素转运相关基因可能是通过营养素感知机制,而不仅是营养物质本身,在衰老调控中发挥核心作用。
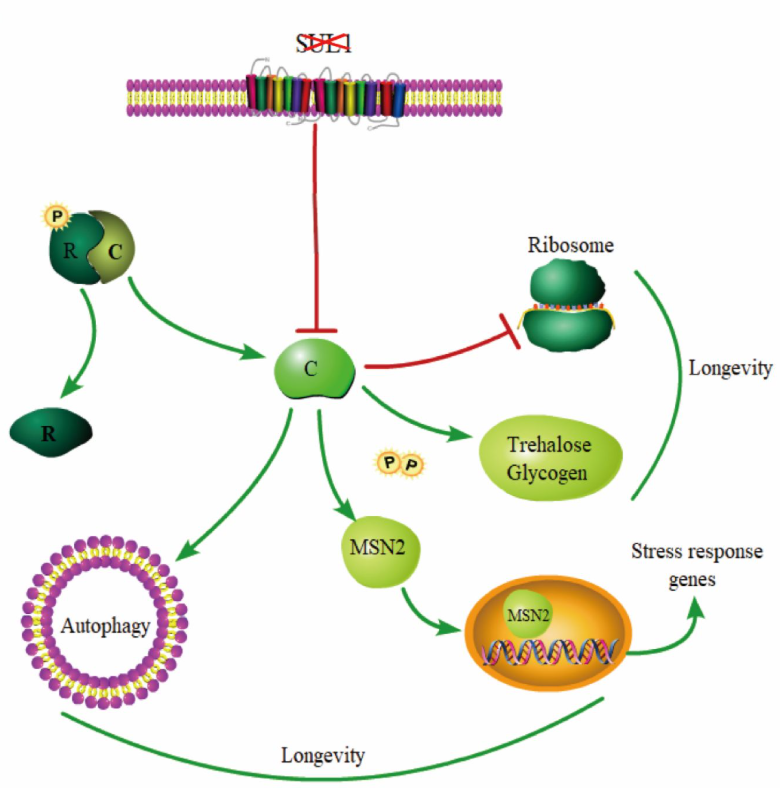
图3: SUL1 基因缺失延长寿命的调控机制
论文1:https://www.sciencedirect.com/science/article/abs/pii/S1525001625007336
论文2: https://www.nature.com/articles/s41380-025-03211-w
论文3:https://doi.org/10.7554/eLife.94609.3
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...