研究开发蛋白质迁移学习方法助力膀胱癌诊断
文章导读
面对膀胱镜的侵入性痛苦,膀胱癌患者如何避免“确诊即晚期”的悲剧?最新突破给出答案:中国科学院团队开发蛋白质迁移学习算法ProteoTransNet,结合纳米蛋白组学技术,将尿液蛋白质组覆盖深度提升55.5%。通过高效整合血清与尿液数据,诊断准确率惊人——AUC高达0.996,分期分类AUC达0.914。这意味着仅凭一次抽血和留尿,就能实现无创、高精度筛查,彻底告别传统膀胱镜的折磨。未来,该方法可推广至多癌种诊断,为精准医学开启革命性新纪元。
— 内容由好学术AI分析文章内容生成,仅供参考。
膀胱镜被视为诊断膀胱癌的“金标准”,但其侵入性使众多患者望而却步。临床上,超过一半患者确诊已属晚期。如何用简便、无创、准确的方法,尽早“筛”查高风险人群,成为研究重点。
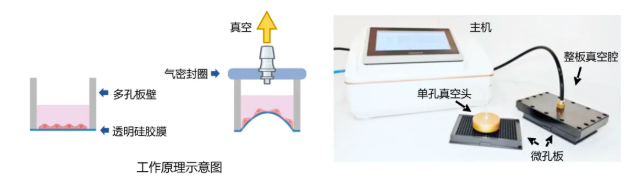
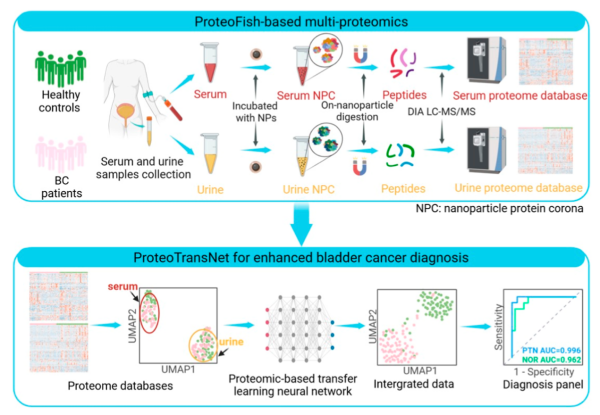
血液与尿液相比于膀胱镜,具有获取便捷、依从性高、无创等优势,是最普遍的诊断样本来源之一。近日,中国科学院杭州医学研究所科研团队,将纳米蛋白组学技术从血液拓展到尿液,较传统尿蛋白沉淀法,提升55.5%的蛋白质组覆盖深度且稳定性更好。
传统尿液蛋白质组研究方法,存在异质性强、复杂度高、覆盖深度有限等问题,传统机器学习方法也难以有效、高质量整合多源数据,因此亟待开发新方法来提升诊断准确性。
团队利用纳米颗粒,“捕获”体液中低丰度蛋白,依托血清蛋白冠和尿液蛋白冠,构建出两个分别含有956种血清蛋白和4730种尿液蛋白的配对蛋白质组数据库。
同时,在自主研发的蛋白质组迁移学习算法(ProteoTransNet)助力下,尿液与血清两类蛋白质组之间实现膀胱癌相关蛋白信息迁移。
依托两个数据库共有蛋白,构建可比表征空间,以源域(血清或尿液蛋白质组)预训练模型,再将其迁移至目标域(尿液或血清蛋白质组)。进而,通过高斯混合模型筛选高可信样本,并通过类别原型对齐与迭代,逐步缩小尿液数据和血清数据间分布差异。
这一策略在统一判别边界内,将尿液的“敏感性”与血清的“稳定性”互补叠加,提升了膀胱癌尿液样本诊断的准确性和鲁棒性。
ProteoTransNet整合数据后,膀胱癌诊断AUC(指roc受试者工作特征的曲线下面积) 达0.996,分期分类AUC为0.914,优于传统方法。
该技术避免了传统膀胱镜侵入性痛苦,通过技术创新与方法突破,构建出膀胱癌诊断新体系。纳米蛋白组学技术解决了血液与尿液蛋白质组深度不足问题,ProteoTransNet模型实现了血清与尿液数据的高效整合,有望实现仅凭一次抽血,一次留尿就可以对膀胱癌早期患者进行高效准确的诊断与筛查。
未来,有望扩大临床样本量,克服配对血清和尿液样本收集难度大、数量有限等问题,进一步验证模型普适性与可靠性;可整合组织蛋白质组等更多维度数据,结合膀胱癌病理机制,挖掘更全面的疾病相关生物标志物,提升诊断与预后评估精准度。
同时,ProteoTransNet有望推广至基因组、转录组等其他组学数据整合,也可应用于其他癌症类型,探索其在多癌种诊断、治疗方案制定和疗效监测方面的潜力,为精准医学领域提供更高效的多组学整合工具与研究思路。
相关研究成果发表在ACS Nano上。
研究开发蛋白质迁移学习方法助力膀胱癌诊断
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...