文章导读
困扰多肽化学界60年的空间位阻肽合成壁垒终于被攻破!南京大学姚祝军/刘发团队受核糖体启发,首创固载化分子反应器(RMMRs),颠覆传统固相合成原理。这项发表于Nature Chemistry的突破性技术,通过模拟生物体内肽键形成机制,让高分子材料表面循环"吞吐"氨基酸,成功解决N-甲基化及α,α-二取代氨基酸的合成噩梦。实验显示:含7个N-Me氨基酸的环孢菌素类似物合成纯度达88%,连续6个α-甲基丙氨酸的十肽粗品纯度高达95%——远超现有技术极限。更重磅的是,该方案已实现自动化生产,抗菌肽alamethicin衍生物机器合成产率达73%,为新型肽类药物研发打通关键卡脖子环节。
— 内容由好学术AI分析文章内容生成,仅供参考。
南京大学化学化工学院姚祝军/刘发团队针对困惑多肽合成领域60余年的难题—空间大位阻多肽的自动化固相合成,提出了一种迭代创新方案:通过创制一种模拟核糖体功能的分子反应器(Ribosome-Mimicking Molecular Reactor, 缩写为RMMRs)并实现固载化,借由高分子材料表面承载的RMMRs循环运作来大幅提高空间位阻肽的固相合成效率,从而完美实现空间位阻肽的高效自动化固相合成。
肽类药物作为重要内源性天然产物,近年来因其高生物活性、目标特异性和良好的安全性而在药物开发中占据重要地位。然而,天然肽的稳定性和细胞膜通透性普遍较差,极大限制了其临床应用。为了克服这些问题,科学家们尝试将非天然氨基酸(如N-甲基化或α,α-二取代氨基酸)引入肽链中,以增强其稳定性和细胞膜通透性。
多肽固相合成方法(Solid-Phase Peptide Synthesis, 简称SPPS)由美国化学家Bruce Merrifield于1963年发明,是多肽自动化合成的原理性基础,该里程碑工作荣获1984年诺贝尔化学奖。依赖于液相中的活性酯与固相支持物上的暴露氨基之间的两相酰基转移反应,这一过程往往受到扩散限制,导致不利的反应动力学表现。为了加速反应,通常采用过量的氨基酸活性酯和其它化学试剂,对于大多数普通肽序列均可实现固相自动化合成。但即便如此,对于上述含有空间位阻氨基酸(如N-甲基化和α,α-二取代氨基酸)的多肽合成则效果很差。过去60多年间,无数的各种努力都无法突破其固相合成和自动化生产。因此,开发一种高效、通用的合成方案来方便地获得这些具有挑战性的空间位阻多肽序列成为多肽化学领域关注的焦点问题。
RMMRs的设计原理
南京大学提出的迭代创新方案模拟了核糖体在翻译过程中的肽基转移机制,设计了一种固载化的循环运行分子反应器(ribosome-mimicking molecular reactors,缩写RMMRs)。核糖体通过将氨酰基-tRNA和肽酰基-tRNA带入紧密接近的状态,促进了快速的肽酰胺键形成。类似地,RMMRs包含两个关键组件:一个肽链锚定点(模拟肽酰基-tRNA)和多个羧基激活位点(模拟氨酰基-tRNA)。在合成过程中,功能化树脂不仅作为固定反应物,还作为循环运作的反应平台,依次接受、激活由操作者投入的各种氨基酸,并以“类似”分子内模板方式完成氨基酸耦合过程中的酰胺键形成。
RMMRs的工作机制包括“开启”和“关闭”两个状态(图1)。在“开启”状态下,通过N,N’-二异丙基碳二亚胺(DIC)将投入氨基酸偶联生成多个活性酯,使暴露的N-末端氨基与空间邻近的激活中间体发生快速的O→N酰基转移。随后,通过哌啶处理“关闭”未反应的活性酯,同时去除肽链末端N-Fmoc保护基,为下一轮氨基酸的连接做准备。这种全新的肽键形成机制显著提高了反应物的有效摩尔浓度,并绕过了从溶液到树脂的不利扩散需求,从而实现了高效的N-酰化。
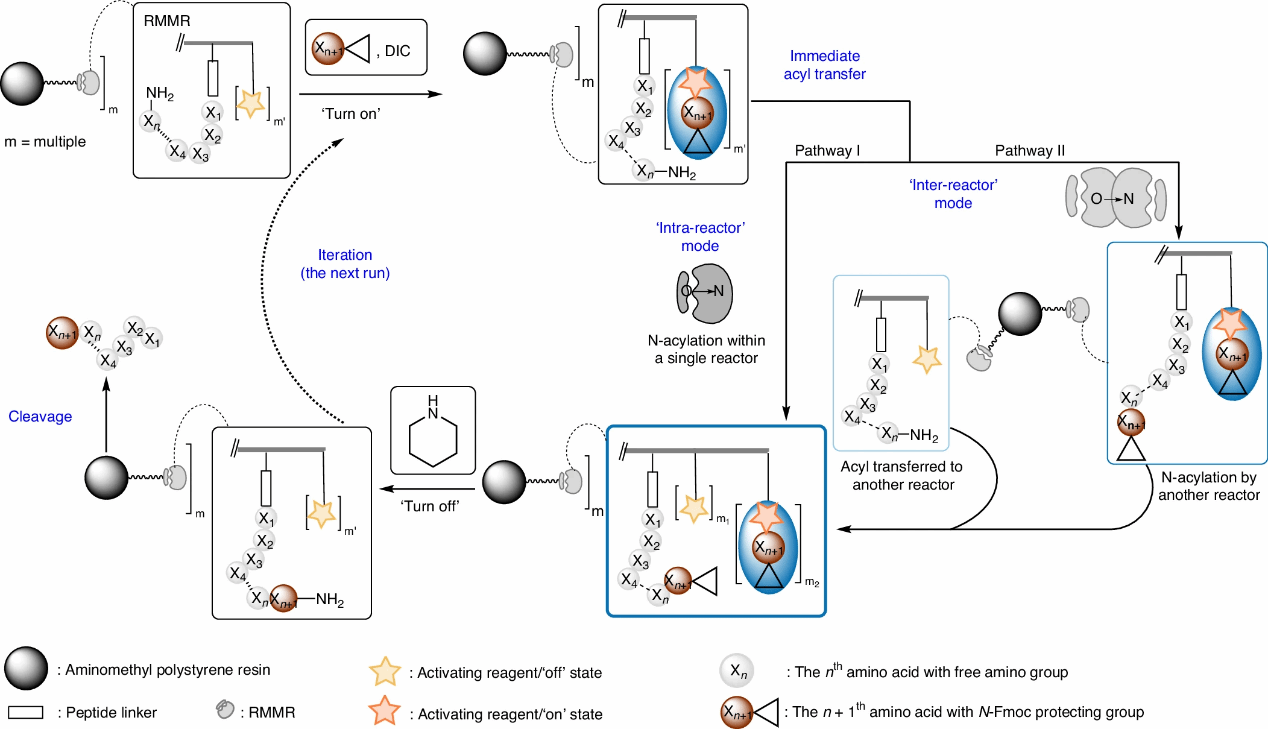
图1. 固载化分子反应器RMMRs循环运作的原理示意图 (摘自Fig. 2 from DOI: 10.1038/s41557-025-01896-8)
实验验证与结果
组装与验证:研究者首先合成了带有四个激活位点的RMMR树脂,并通过液相色谱-质谱联用技术(LC-MS)验证了其合成短肽和常规多肽的能力。结果显示,使用RMMR树脂合成的目标肽纯度与标准Rink酰胺树脂相当,证明了RMMR树脂在常规多肽合成中具有和传统SPPS方式同等的有效性。
N-甲基化肽的合成:进一步,研究者评估了RMMR树脂在合成含有N-甲基化氨基酸的肽中的表现(图2左侧)。实验结果表明,RMMR树脂在合成含有单个或多个N-甲基化氨基酸的肽时,均表现出显著更高的目标酰胺键形成效率和高达98%的粗产物纯度。特别是对于含有连续N-甲基化氨基酸的肽,RMMR树脂的优势更加明显。例如采用RMMR SPPS的cyclosporin A类似物合成范例显示,含有7个N-Me氨基酸的链状11肽最终粗产品纯度可达88%;经分离纯化,其产率可达70%,大大超越了现有文献报道的所有结果。
α,α-二取代肽的合成:除了N-甲基化肽外,RMMR树脂还成功应用于合成含有α,α-二取代氨基酸的肽。这些肽由于空间位阻更大,传统SPPS方法难以合成。然而,使用RMMR树脂后,研究者成功合成了多种含有两个连续或非连续α,α-二取代氨基酸的肽,且产物纯度均较高(图2右侧)。范例显示,采用RMMR SPPS可完美合成含有连续六个α-甲基丙氨酸(Aib)的10肽序列,粗产物纯度高达95%;此结果开创了一项前所未有的记录。
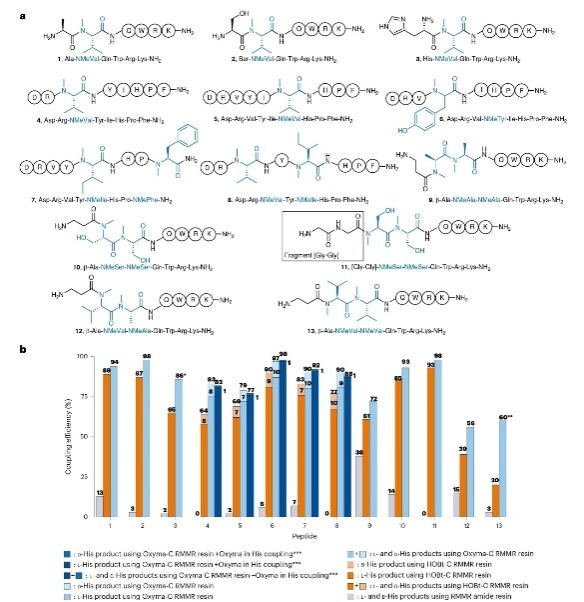
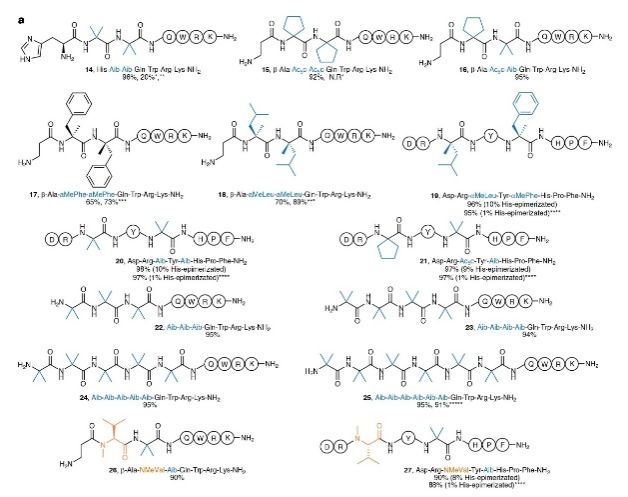
图2:含N-甲基和α,α-双取代大位阻氨基酸的多肽底物拓展
自动化与规模化生产:为了验证RMMR协议的自动化和规模化生产潜力,研究者选取少数挑战性空间位阻多肽序列,采用通用多肽合成仪进行了自动化合成实验。结果显示,自动化合成与手动操作的结果相当,证明了RMMR SPPS在工业生产中的巨大潜力。范例中还包括了抗菌肽alamethicin F衍生物的RMMR SPPS,该二十肽序列中包含了八个α-甲基丙氨酸(Aib)残基,其机器自动化合成的粗产品纯度可达88%,分离纯化后产率为73%,结果极为惊艳。
RMMR SPPS迭代原理技术颠覆了历经60余年的传统多肽固相合成工作原理,不仅覆盖现有技术可合成的多肽底物范围,还把以前无法实现的空间大位阻多肽的固相合成及其自动化变成了现实。该方案通过模拟核糖体的肽基转移机制显著提高了大位阻酰胺键的形成效率,成功突破了含有N-甲基化和α,α-二取代氨基酸的复杂多肽序列的高效率固相合成难题,是多肽固相自动化合成领域的又一次里程碑式重大突破性进展。未来,RMMR SPPS技术有望在药物和特殊生物材料开发中发挥更大作用,推动更多具有挑战性的肽类药物的研发和应用。
相关研究成果于2025年8月6日以“Immobilized acyl-transfer molecular reactors enable the solid-phase synthesis of sterically hindered peptides”为题发表于Nature Chemistry(Wei, S. (魏思媛); Zhang, X. (张徐纯); Yang, X. (杨晓亮); Liu, F. (刘发); Yao, Z.-J. (姚祝军) Nat. Chem. 2025, DOI: 10.1038/s41557-025-01896-8; released online on 6th August 2025)。(Wei, S.; Zhang, X.; Yang, X.; Liu, F.; Yao, Z.-J. Nat. Chem. 2025, DOI: 10.1038/s41557-025-01896-8; released online on 6th August 2025)。该项创新技术同时也申请了中国发明专利(CN202410411592X)和国际专利(PCT/CN2025/07126)的知识产权保护。

上述工作获得了国家自然科学基金原创探索计划项目(No. 22450003)的立项资助。南京大学化学化工学院博士研究生魏思媛、张徐纯共同完成了实验性工作和数据的采集整理与分析,杨晓亮副教授参与了前期工作,姚祝军教授和刘发博士设计并指导了该项课题。
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...