研究揭示(R)-选择性苯乙烯单加氧酶晶体结构及其立体调控机制
文章导读
光学纯环氧化合物是药物合成的命脉,但为何精准控制其立体结构始终是行业瓶颈?中科院团队重磅揭秘:首次解析(R)-选择性苯乙烯单加氧酶SeStyA晶体结构,发现A59、S178等关键位点竟上演“分子拔河”——近端与远端残基大小博弈直接决定(R)或(S)产物选择性。基于这一颠覆性机制,研究成功构建高选择性突变体,精准催化不同烯烃环氧化。这项发表于《德国应用化学》的突破,为定制绿色合成酶制剂扫清障碍,医药农药研发效率或将迎来质的飞跃。
— 内容由好学术AI分析文章内容生成,仅供参考。
光学纯环氧化合物是制备部分医药、农药、天然活性物质的重要前体,烯烃不对称环氧化是制备光学纯环氧最直接有效的方法之一。苯乙烯单加氧酶能够催化部分烯烃不对称环氧化来制备光学纯(R)-或(S)-环氧化合物。然而,该酶催化烯烃不对称环氧化的立体调控机制尚不明晰,阻碍了学界通过蛋白质工程改造获得立体选择性高且底物谱宽泛的酶制剂。
针对上述问题,中国科学院成都生物研究所联合深圳先进技术研究院及河南农业大学,解析了(R)-选择性苯乙烯单加氧酶SeStyA晶体结构,并结合计算模拟分析,阐释了(R)-选择性苯乙烯单加氧酶催化烯烃环氧化的立体调控机制,为构建催化不同底物的(R)-或(S)-立体选择性环氧化突变体提供理论指导。
研究人员解析了来自链霉菌Streptomyces vilmorinianum的(R)-选择性苯乙烯单加氧酶SeStyA晶体结构,并结合分子动力学模拟,确定了活性中心的A59、A312、S178及A219位点或为控制该酶催化环氧化立体选择性的关键位点。同时,研究人员通过点突变分析发现,C=C近端残基(A59和A312)与远端残基(S178和A219)大小决定该酶催化的立体选择性。立体选择性机制遵循“拔河”模式,即大近端残基和小远端残基将该酶“拉向”(R)-立体偏好性,而小近端残基和大远端残基将该酶“拉向”(S)-立体偏好性。这一“拔河”模式在其他苯乙烯单加氧酶AaStyA和NaStyA中得到验证。
进一步,在该“拔河”模式立体控制机制指导下,研究人员深入分析了各位点间的协同效应,并构建了一系列针对不同类型化合物具有优异(R)-或(S)-立体选择性的突变体。研究通过分子动力学模拟,阐明了该“拔河”模式的分子基础。结果显示,底物在含大远端突变体S178Y中,以Re-face构型结合的自由能低于Si-face构型,生成(S)-环氧产物;而底物在含大近端小远端突变体Mut4R(S178G/F57A/A312F/A59M)中,以Si-face构型结合的自由能低于Re-face构型,生成(S)-环氧产物。因此,底物在酶催化活性中的结合构型决定了该酶催化的立体选择性。
近日,相关研究成果发表在《德国应用化学》(Angewandte Chemie International Edition)上。研究工作得到国家自然科学基金委员会、四川省等的支持。
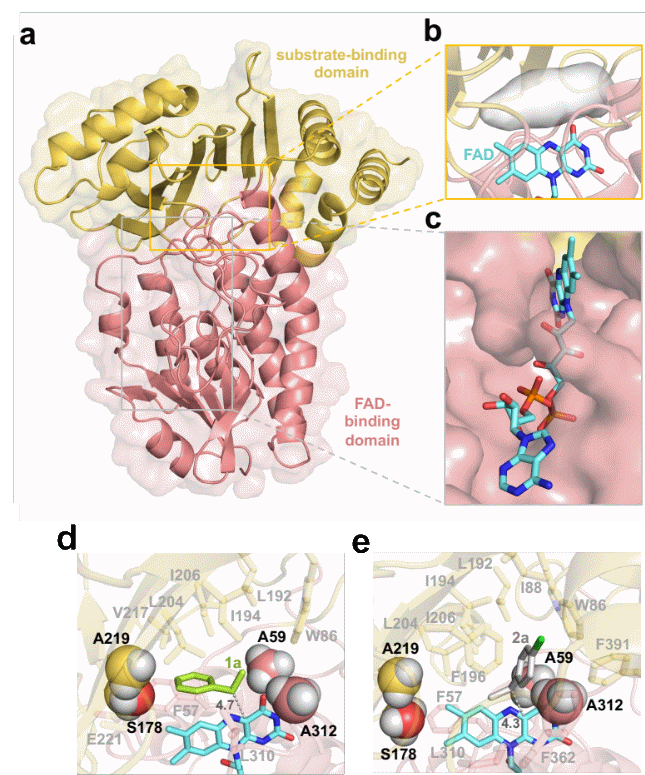
SeStyA晶体结构及影响其催化立体选择性的关键位点解析
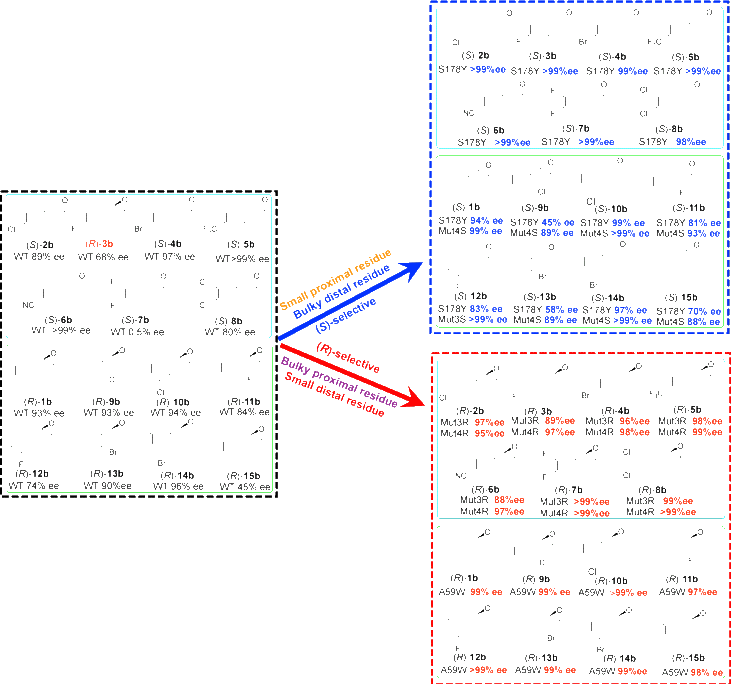
SeStyA(左)及其突变体(右)立体选择性催化不同烯烃环氧化
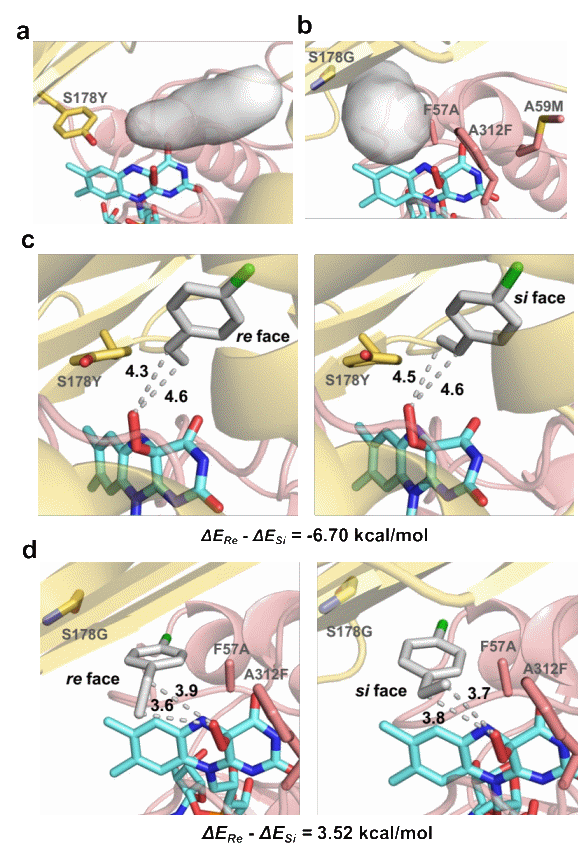
SeStyA及其突变体与不同构象底物的结合自由能分析
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...