脂滴聚集复合物组分解析和调控机制研究获进展
文章导读
你是否想过,细胞内的“能量仓库”脂滴是如何与其他细胞器精密协作,调控整个细胞代谢的?长久以来,这一动态过程背后的分子机制一直是个谜。中科院大连化物所等团队的一项突破性研究,运用全新的光催化邻近标记技术,首次在活细胞内原位精准捕捉了脂滴的互作网络。他们不仅找到了调控脂滴与线粒体互动的关键蛋白轴,更揭示了这一“对话”如何深刻影响细胞的能量与脂质代谢。这项发表于《自然-化学生物学》的研究,为理解代谢疾病与神经退行性疾病的发病机制,提供了至关重要的新工具与线索。
— 内容由好学术AI分析文章内容生成,仅供参考。
生物体中的蛋白质、核酸和脂质等生物分子在应激和疾病条件下易发生聚集,形成生物聚集体。其中,脂滴作为细胞内一种高度动态的生物聚集体,是脂质储存与代谢调控的核心亚细胞器,并与线粒体和内质网等细胞器频繁互动,兼具能量供应、膜脂合成前体储备及细胞应激保护等关键功能,对细胞代谢重编程与多种疾病发生发展具有重要意义。然而,学界对调控脂滴与亚细胞器互作聚集的分子机制尚不明晰。
近日,中国科学院大连化学物理研究所等团队,建立了基于小分子光催化剂的蛋白质邻近标记技术(LipoID)。
传统脂滴离体分离分析技术面临脂滴易破碎、弱/瞬时互作丢失、非特异吸附等技术挑战,难以在活细胞原位、工况条件下精准还原真实的互作网络信息。 针对上述技术瓶颈,团队提出并建立了LipoID光催化邻近标记策略:通过设计具有脂滴靶向能力与光催化活性的小分子探针,可富集于活细胞脂滴微环境;温和短时光照触发探针产生活性中间体,介导脂滴邻近区域蛋白质的快速标记。团队还建立了富集纯化与高分辨质谱鉴定方法,实现了脂滴互作蛋白组的高覆盖精准解析,且该方法覆盖多类脂代谢相关酶与调控因子,验证了其用于脂滴互作网络解析的可靠性。
团队进一步聚焦“调控脂滴与亚细胞器互作聚集的分子机制是什么?”这一核心科学问题,利用LipoID比较蛋白组学技术,鉴定出“PLIN3—VDAC3—ATP—线粒体互作”这一关键调控轴。研究证实,抑制VDAC3会降低细胞ATP水平,增大脂滴—线粒体的空间距离,还会驱动脂滴—线粒体—微管空间耦联的重构,并引发甘油三酯、胆固醇酯、游离脂肪酸等脂质代谢通路的系统性改变。
该研究为理解脂滴—亚细胞器聚集互作提供了组学分析工具,为深入探索代谢与神经退行性疾病中脂滴聚集体的生理病理角色奠定了基础。
相关研究成果发表在《自然-化学生物学》(Nature Chemical Biology)上。研究工作得到国家自然科学基金会员会等的支持。
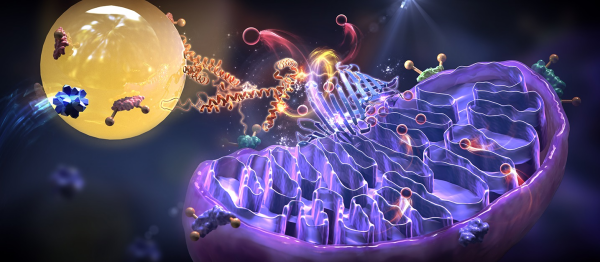
研究开发脂滴聚集体的光催化邻近标记与组学解析新技术
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。



















这个LipoID比传统方法好用在哪?有人试过没
看标题以为是减肥,结果这么硬核😂