研究揭示细菌逆转录酶介导新型免疫机制
文章导读
当噬菌体入侵,细菌竟用病毒蛋白启动"自杀式防御"?中科院武汉病毒所最新研究震撼揭秘:DRT4系统如何让感染个体"同归于尽"保全群体!病毒ORF55蛋白成为致命扳机,触发细菌逆转录酶进行"无模板"DNA合成——无需模板即可随机制造毒性单链DNA,导致细胞死亡。更关键的是,该机制存在于幽门螺杆菌等致病菌中,靶向激活DRT4或能精准诱导耐药菌自杀,为全球抗生素危机提供全新突破口。读完即掌握颠覆认知的细菌免疫逻辑与抗菌新策略。
— 内容由好学术AI分析文章内容生成,仅供参考。
近日,中国科学院武汉病毒研究所团队,揭示了新型细菌抗病毒防御系统DRT4的工作机制。研究发现,在遭遇噬菌体入侵时,带有DRT4防御系统的细菌通过“自杀式防御”策略,牺牲被感染个体以保全群体。这一防御系统的启动“钥匙”来自于病毒自身编码的一种核酸结合蛋白。
研究团队综合运用生物化学、生物物理学及微生物学等多种研究手段,从分子层面解析了DRT4系统的防御机制。团队发现,该机制具有独特的“无模板”DNA合成能力,尽管DRT4被定义为原核生物逆转录酶家族,但其具有不依赖模板合成随机序列的单链DNA的酶活性。这一非典型聚合酶活性是其执行防御功能的核心基础。同时,DRT4上高度保守的酪氨酸残基(Tyr125)作为DNA合成的起始位点,揭示了其利用蛋白作为引物合成单链DNA的机制。
研究发现,病毒蛋白为系统“触发器”,T5噬菌体编码的单链DNA 3‘末端结合蛋白ORF55,是激活防御的“扳机”。在未感染状态下,细菌体内的3‘—5‘核酸外切酶,会持续降解DRT4合成的单链DNA,防止其对自身造成损害。一旦噬菌体入侵,其ORF55蛋白会结合到单链DNA产物的末端,保护其免于降解。团队进一步发现,被ORF55保护的单链DNA在细胞内大量累积,最终产生毒性效应,导致被感染细菌死亡,实现与入侵噬菌体的“同归于尽”。
该研究从分子层面阐释了DRT4这一单基因抗病毒系统的作用机制,拓展了学界对细菌逆转录酶功能多样性的认知,为理解细菌与噬菌体之间复杂的协同进化关系提供了新视角。同时,DRT4存在于脑膜炎奈瑟菌和幽门螺杆菌等多种致病菌中,通过靶向激活病原菌内部的DRT4通路,有望诱导其“自杀”,从而开发出针对耐药性细菌感染的新抗菌策略,为应对全球日益严峻的抗生素耐药性挑战提供新的解决方案。
相关研究成果发表在《自然-通讯》(Nature Communications)上。
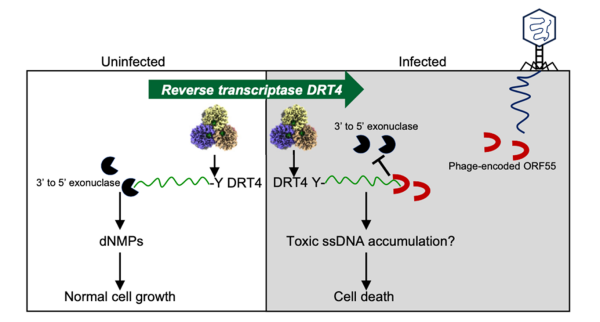
DRT4介导的抗噬菌体免疫工作模式图
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。



















“无模板”合成DNA?这机制也太反常识了吧!
又一篇《自然》子刊,中科院牛啊!👍
所以DRT4在幽门螺杆菌里也有?那是不是有望根治胃病了?
细菌和噬菌体的博弈比谍战还刺激!坐等后续应用~
看完只想问:能快点用到耐药菌治疗上吗?
这研究太硬核了,细菌还会“自杀式防御”?🤯