文章导读
当3500例脑影像数据散落全球16个临床中心,传统方法因样本局限寸步难行,南京大学张冰教授与丘成桐院士团队如何用数学理论一招破局?他们首创融合最优传输与张量分解的OMT-APC深度学习模型,不仅将脑病灶分割精度推至95%以上,更在遗传标志物预测中实现IDH突变91.7%、1p/19q缺失80.9%的突破性准确率——远超人类专家水平。如今该成果已落地鼓楼医院临床一线,大幅提升诊断效率,为脑疾病智能诊疗开启新纪元。读完本文,你将掌握这场数学与医学跨界革命的核心逻辑与真实价值。
— 内容由好学术AI分析文章内容生成,仅供参考。
南京大学张冰教授团队与南京应用数学中心、清华大学丘成桐院士团队及海内外多位专家密切合作,攻克多中心大数据脑影像配准难题,标志着我校神经影像学与数学交叉的脑科学研究方面跻身世界前沿。
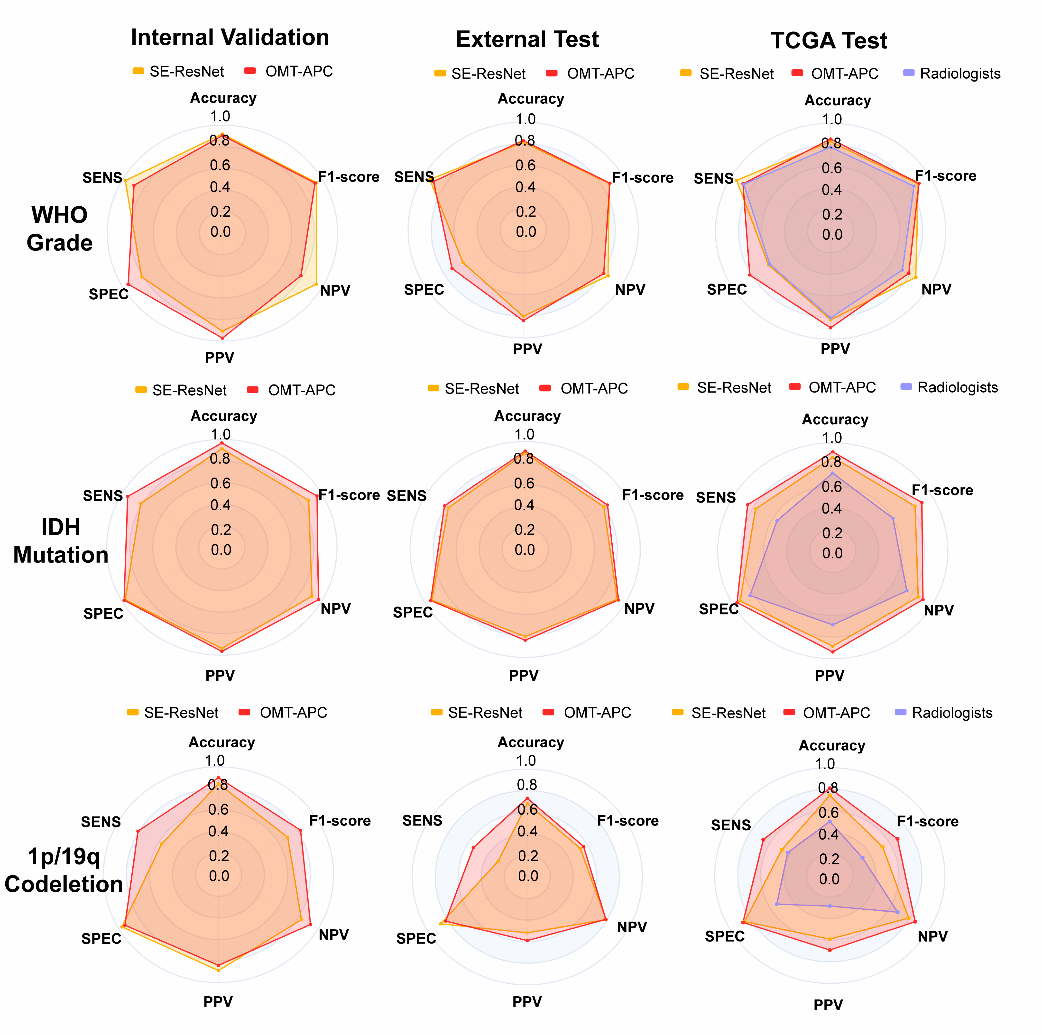
该研究基于最优传输(Optimal Mass Transport, OMT)方法对来自中国、欧洲与美国共16个临床中心,超过3500例不同患者的脑影像进行标准化对齐,结合密度函数增强感兴趣区影像特征,实现了跨中心数据的一致性预处理,攻克多数研究受限于样本量较小和数据来源的单一性,难以实现大规模临床推广的难题。同时,研究团队提出基于张量奇异值分解(Tensor SVD)的代数特征建模方法,巧妙融合进深度神经网络结构中,提出一种融合最优传输理论与代数张量分解的深度学习模型(OMT-APC模型),开发出具有高精度、高鲁棒性的深度学习模型,实现了感兴趣区的精准分割,大幅提升模型对脑疾病的识别能力和对关键遗传标志物的预测效能。
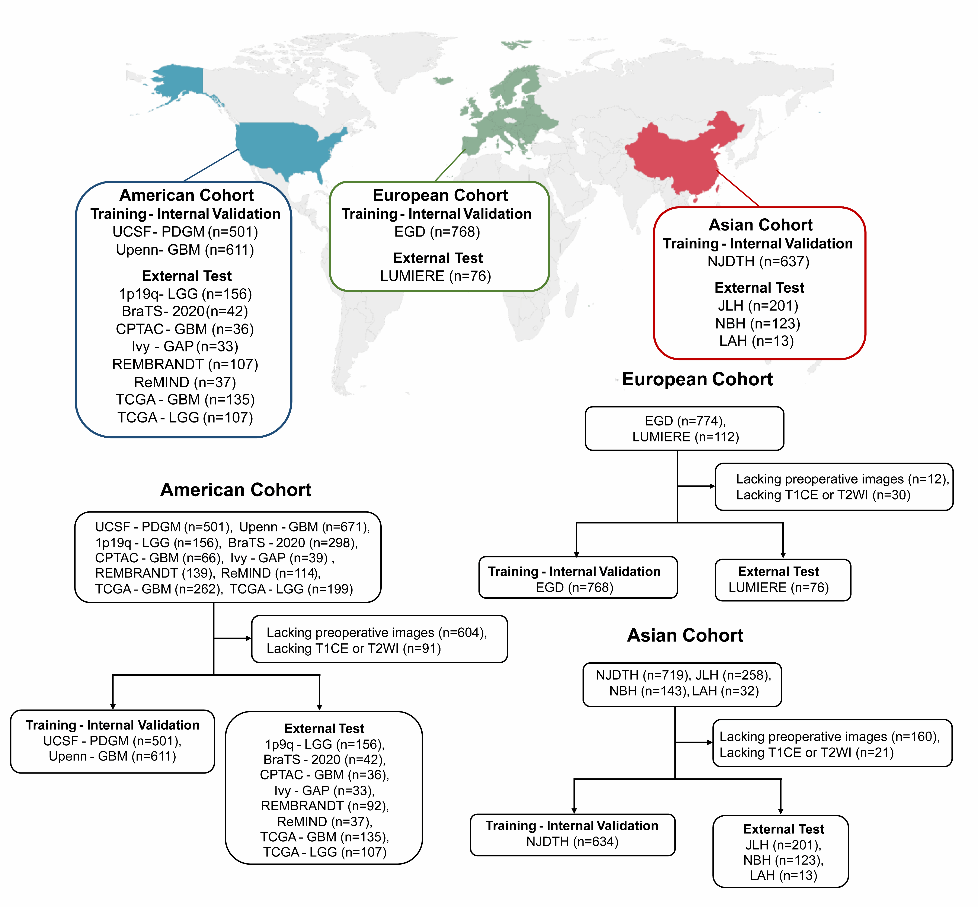
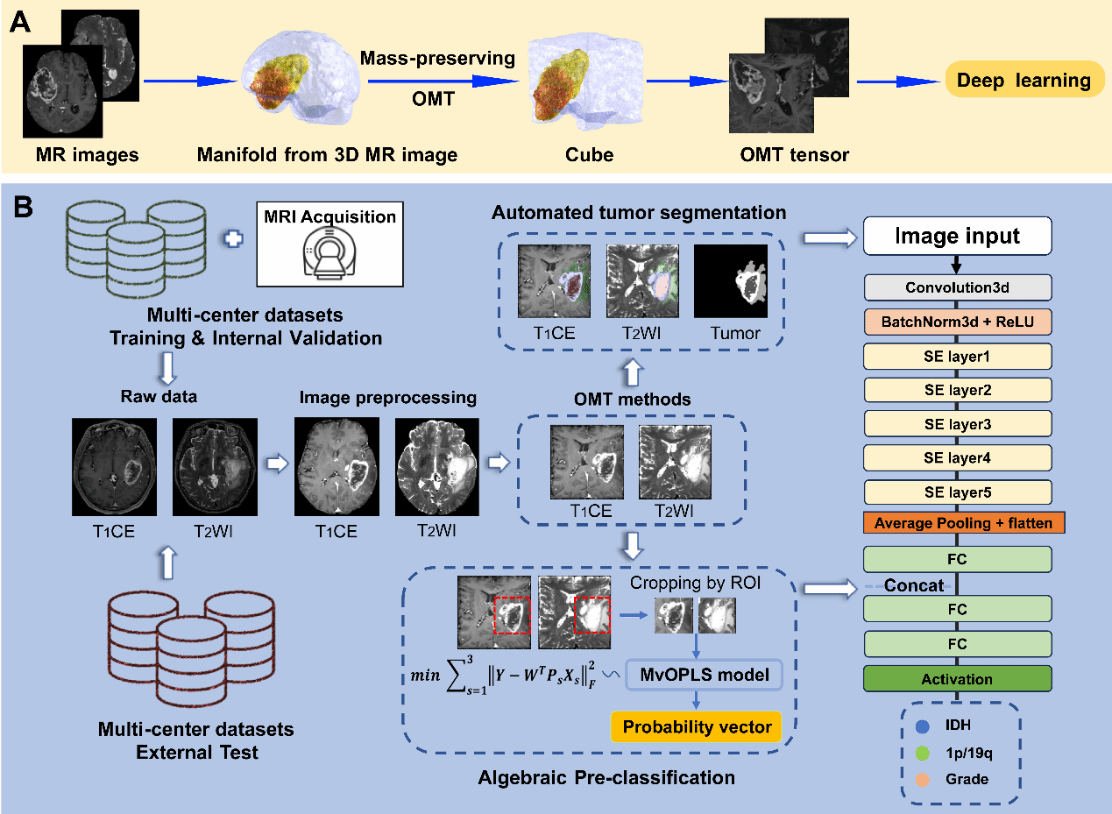
该模型不仅在分割精度上表现优异:病灶区域精度达95%以上,在多项遗传标志物预测任务中取得突破:在TCGA标准测试集上,IDH突变预测准确率达91.7%,1p/19q共缺失预测准确率为80.9%,均显著优于现有模型及人类专家水平。
临床转化:从实验室到真实场景的落地应用
目前,该研究成果已在南京大学医学院附属鼓楼医院完成系统部署,并投入临床实际应用,参与前瞻性临床试验,助力脑疾病诊断流程智能化升级。模型的高效性与稳定性,有效提升了医生对患者影像数据的分析效率,显著减轻人工标注负担,并推动多模态影像在临床决策支持中的实际应用。
论文题目为“OMT and tensor SVD-based deep learning model for segmentation and predicting genetic markers of glioma: A multicenter study”, 2025年7月8日,发表于《PNAS》。本研究第一作者为南京大学在读博士生朱正阳,也标志着张冰教授课题组在脑影像科学交叉人才培养方面取得显著成效。同时该论文的共同第一作者还有南京应用数学中心王瀚博士、东南大学数学系李铁香教授、台湾师范大学黄聪明教授、鼓楼医院医学影像科杨惠泉医师、神经外科陶震楠医师。共同通讯作者包括南京应用数学中心林文伟教授、丘成桐院士、鼓楼医院医学影像科张鑫主任,南京大学张冰教授为最后通讯作者。该研究得到了国家自然科学基金、科技创新2030—“脑科学与类脑研究”重大项目、江苏省重点研发计划等基金项目的资助。

原文链接:https://doi.org/10.1073/pnas.2500004122
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...