西北农林科技大学(726)动物干细胞研究与应用团队在布鲁氏菌致病机制研究方面取得新进展
文章导读
布鲁氏菌如何躲过免疫系统疯狂增殖?西北农科团队首次揭示其关键“隐身术”!研究发现,这种危险病原体竟利用BLOC1S1蛋白作为“分子镣铐”,通过空间禁锢TDP-43蛋白阻断其核转位,大幅削弱宿主细胞的自噬防御能力——这正是布鲁氏菌在细胞内建立“细菌堡垒”的核心机制。该突破性成果不仅破解了人畜共患病的关键致病密码,更意外发现BLOC1S1-TDP-43调控轴可能成为抗击布鲁氏菌病和神经退行性疾病的"双重新靶点",为千万养殖户和公共卫生安全带来曙光。
— 内容由好学术AI分析文章内容生成,仅供参考。
布鲁氏菌病是当前我国重点防控的人畜共患传染病之一,对公共卫生安全和畜牧养殖业构成了严重威胁,如何有效防控布鲁氏菌的感染是一项急需解决的重大问题。近日,西北农林科技大学动物医学院动物干细胞研究与应用团队在布鲁氏菌致病机制研究方面取得新进展,相关成果以“BLOC1S1 Attenuates B. Melitensis 16M LPS-Triggered Autophagy by Spatial Confinement of TDP-43”为题在国际期刊《Advanced Science》上发表。该研究揭示了BLOC1S1蛋白通过“空间禁锢”关键分子TDP-43来抑制布鲁氏菌LPS引发的自噬的分子机制,为探究布鲁氏菌的致病机制提供了宝贵的理论基础。
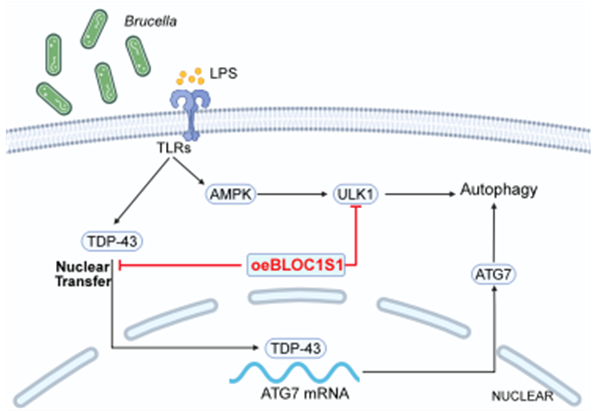
布鲁氏菌作为革兰氏阴性细胞内病原体,通过其脂多糖(LPS)等毒力因子在宿主细胞内形成含菌液泡(BCVs)并实现增殖。该研究聚焦于布鲁氏菌16M LPS通过激活AMPK诱导山羊精原干细胞自噬的过程,研究发现生物发生的溶酶体相关细胞器复合物1亚基1(BLOC1S1)通过与RNA结合蛋白TDP-43结合,限制其核转位,从而降低ATG7 mRNA稳定性及自噬体形成,最终减弱LPS诱导的自噬。BLOC1S1-TDP-43-ATG7这一调控轴的揭示,不仅深化了对布鲁氏菌感染过程中自噬调控机制的理解,也为布鲁氏菌病及TDP-43相关神经病理疾病的治疗提供了潜在靶点。
动物医学院华进联研究员、李娜副研究员和广州医科大学附属市八医院于海生教授为论文的通讯作者。在读博士生万仕成、韩苗为论文的共同第一作者。该研究得到了国家重点研发计划、国家自然科学基金、陕西省畜牧业关键技术示范等项目的支持。
原文链接:https://pubmed.ncbi.nlm.nih.gov/40936170/
编辑:张晴
终审:刘玉峰
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...